
- •Введение в органическую химию Оглавление
- •Введение в органическую химию
- •Бутан изобутан
- •Бутан изобутан
- •Пентан изопентан неопентан
- •Пропан бутан изобутан пентан изопентан неопентан
- •Классификация и номенклатура
- •1.1. Углеводороды
- •Пропан пропен (пропилен) пропин (метилацетилен)
- •1.2. Функциональные группы
- •2. Ковалентная связь
- •2.1. Электроотрицательность и виды связей
- •Связь Разница в Тип связи
- •2.2. Углы между связями и форма молекул
- •2.3. Атомные и молекулярные орбитали
- •Основное состояние возбужденное состояние атома углерода
- •2P орбиталей углерода с образованием четырех sp3-гибридных орбиталей.
- •Ао атома углерода и ао четырех атомов водорода.
- •2.4. Длина и энергия связи
- •3. Кислоты и основания
- •3.1. Кислоты и основания по Бренстеду-Лоури
- •3.2. Строение молекулы и кислотность
- •3.3. Кислоты и основания Льюиса
- •4. Хиральность
- •4.1. Энантиомерия.
- •4.2. Стереохимическая номенклатура
Введение в органическую химию Оглавление
А.Структурная теория 2
Б.Формулы органических соединений. Структурная изомерия 3
1. Классификация и номенклатура органических соединений 4
1.1. Углеводороды 4
1.2. Функциональные группы 6
А. Спирты 6
Б. Альдегиды и кетоны 7
В. Карбоновые кислоты 8
Г. Эфиры карбоновых кислот 8
2. Ковалентная связь 9
2.1. Электроотрицательность и виды связей . 9
А. Индуктивный эффект 10
2.2. Углы между связями и форма молекул 12
А. Резонанс 14
2.3. Атомные и молекулярные орбитали 16
А. Гибридизация атомных орбиталей 17
2.4. Длина и энергия связи 20
3. Кислоты и основания 22
3.1. Кислоты и основания по Бренстеду-Лоури 22
3.2. Строение молекулы и кислотность 23
А. Электроотрицательность атома в кислотном центре 23
Б. Индуктивный эффект и электростатическая стабилизация аниона 23
В. Влияние гибридизации 24
3.3. Кислоты и основания Льюиса 24
4. Хиральность 25
4.1. Энантиомерия 26
4.2. Стереохимическая номенклатура 27
Введение в органическую химию
Чаще всего органическую химию определяют как химию соединений углерода. Органические соединения состоят в основном из углерода водорода, кислорода и азота, и значительно реже из серы и других элементов. Из этих элементов состоят основные вещества, обеспечивающие жизнь на нашей планете. Органические вещества мы используем в пищу, из них состоит наша одежда, мы сжигаем их для отопления. Словом, мы живем в мире органической химии.
Сам термин «органическая химия» был введен в 1808 г. шведским химиком Берцелиусом. С тех пор уже получено более 20 миллионов органических соединений, и это составляет лишь небольшую часть всего возможного.
А. Структурная теория
В 70 - 80-х годах 19 века появилась структурная теория. В создание структурной теории органической химии внесли свой вклад такие ученые как Бутлеров А. М., немец Кекуле и шотландец Купер. Кекуле установил четырехвалентность углерода и одновременно с Купером развил идею о способности углеродных атомов соединяться в длинные цепи. Купер предложил современную систему изображения связей между атомами в молекулах с помощью черточек.
Основные положения структурной теории:
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Химическое строение можно устанавливать химическими и физикохмическими методами.
Свойства веществ зависят от строения их молекул.
По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Несмотря на всю сложность, в органической химии существует строгая система классов соединений и типов реакций. Фактический материал органической химии может быть организован по классам органических соединений или по типам реакций. Мы будем придерживаться смешанного принципа основной материал изучать по классам органических соединений, а наиболее важные типы реакций и их механизмы рассматривать в виде отдельных разделов при обсуждении тех классов органических соединений, для которых эти реакции наиболее характерны.
Поскольку понимание реакций простейших молекул без изменения можно использовать и в случае сложных, в том числе и полимерных молекул мы будем следовать принципу: знакомиться с реакциями на примере молекул, содержащих наименьшее количество атомов углерода, а затем рассматривать аналогичные реакции более сложных соединений этого класса.
Углерод чаще всего образует ковалентные связи. Поэтому органическую химию можно считать химией ковалентных связей.
Б. Формулы органических соединений. Структурная изомерия
Состав и строение соединений изображают формулами. Количество атомов каждого элемента в молекуле органического соединения показывают молекулярными формулами, например, СН4 - метан, С2Н6 - этан, С3Н8 - пропан.
Для изображения последовательности соединения атомов в молекуле и связей между ними используют структурные формулы, например:

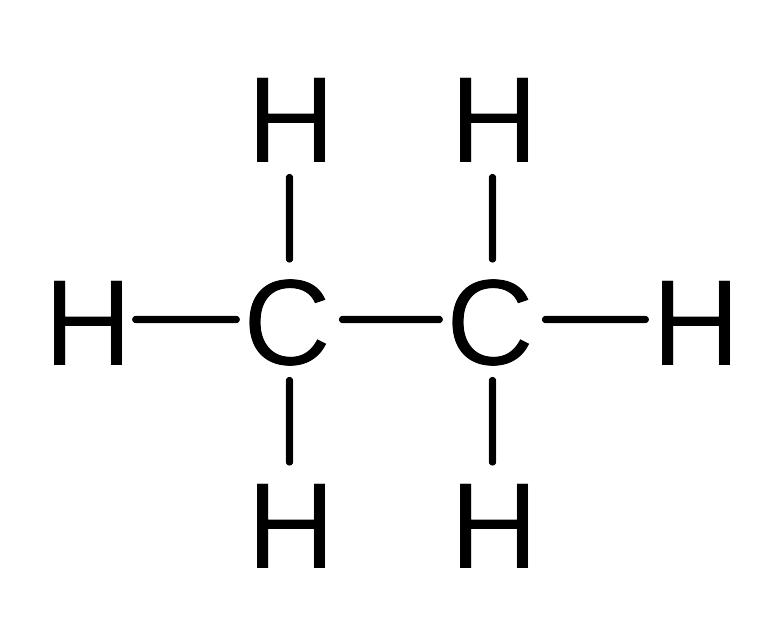
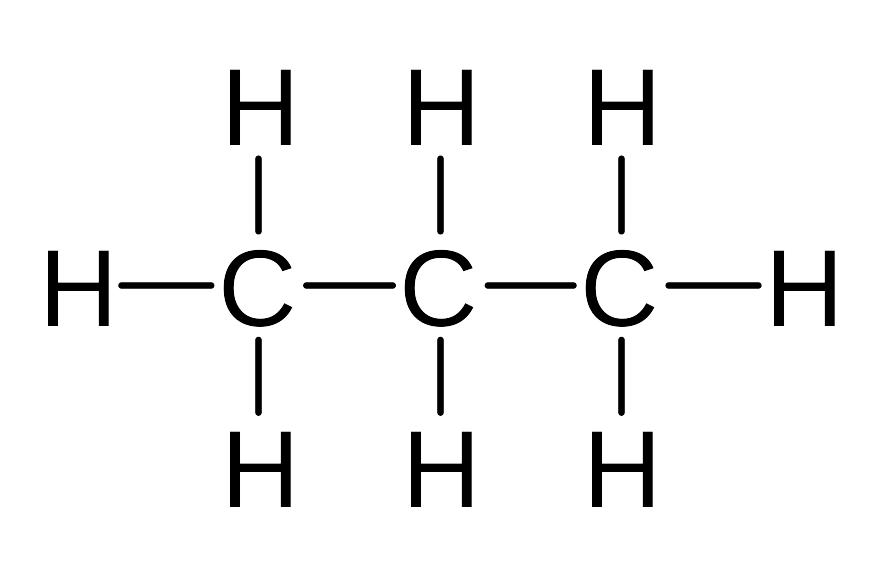
метан этан пропан
Одна и та же молекулярная формула может соответствовать нескольким молекулам, в которых одни и те же атомы могут располагаться в разной последовательности. Например, молекулярной формуле С4Н10 соответствуют две структурные формулы, соответствующие двум разным соединениям:

