
- •Структура, свойства и функции белков.
- •Универсальность первичной структуры. Белки, выполняющие одинаковые функции в разных организмах имеют одинаковую или близкую первичную структуру.
- •В природных белках одна и та же аминокислота не встречается подряд больше 3 раз.
- •Структура и свойства ферментов.
- •Для ферментов и неорганических катализаторов характерны общие свойства:
- •Ферменты классифицируют по химической структуре:
- •Функции белковой и небелковой части фермента.
- •Факторы, влияющие на активность ферментов.
- •Анализ уравнения Михаэлиса-Ментен.
- •Km показывает:
- •Зависимость скорости ферментативной реакции от концентрации фермента.
- •Зависимость скорости ферментативной реакции от температуры.
- •Зависимость скорости реакции от рН
- •Влияние рН.
- •Классификация ферментов.
- •Номенклатура ферментов.
- •Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
- •Дегидрирование гидроксильных групп
- •Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
- •Дегидрирование аминогрупп
- •Влияние низкомолекулярных веществ на активность фенрментов.
- •Значение ингибирования активности ферментов.
- •Ингибирование бывает 2-х видов:
- •Необратимое ингибирование
- •Конкурентное
- •Неконкурентное
- •Vmax – одинакова
- •Неконкурентное, обратимое ингибирование.
- •Vmax – уменьшается.
- •Различают три вида регуляторных ферментов:
- •Активация зимогенов.
- •Уровни организации ферментов в клетке.
- •I уровень организации
- •II уровень организации
- •III уровень организации
- •Биологическое окисление.
- •Сходство между окислением в организме и вне организма.
- •Различия между окислением в организме и вне организма.
- •Виды биологического окисления.
- •Строение дыхательной цепи.
- •Пути использования энергии переноса электронов.
- •Энергия переноса электронов используется на синтез атф.
- •Энергия переноса электронов используется для выработки тепла.
- •Причины нарушения биологического окисления.
- •Обмен углеводов.
- •Обмен углеводов.
- •Значение углеводов в организме:
- •Углеводы – это основной энергетический материал.
- •Углеводы выполняют пластическую функцию. К ним относятся пентозы нуклеотидов и гликопротеинов, гетерополисахариды межклеточного вещества.
- •Углеводы могут превращаться в липиды и некоторые аминокислоты.
- •Гликолиз.
- •Стадии гликолиза.
- •1. Фосфорилирование глюкозы: реакция протекает необратимо, катализируется гексокиназой и требует затраты атф:
- •Значение анаэробного гликолиза:
- •II. При достаточном содержании о2 в клетке глю окисляется до конечных продуктов – со2, н2о и этот процесс называется аэробным окислением глю.
- •Глицерофосфатный челночный механизм;
- •Малатно-аспартатный челночный механизм. Глицерофосфатный челночный механизм.
- •Малатный челночный механизм.
- •Баланс аэробного гликолиза:
- •Анаэробный гликолиз – субстратное фосфорилирование – 2атф
- •2Пир 2 сн3соsKoА – окислительное декарбоксилирование 2 надн- 6атф
- •Регенерация 2 надн в челночном механизме - 6 атф
- •Включение в гликолиз других моносахаридов.
- •Пентозофосфатный (апотамический) путь окисления глюкозы.
- •Надфн, d используется как источник восстановительных эквивалентов в процессах биосинтеза жирных кислот, стероидов.
- •Рибозо-5-фосфата (пентозы), d используется для синтеза нуклеиновых кислот.
- •Образование атф.
- •Взаимосвязь пентозного пути и гликолиза.
- •Обмен гликогена.
- •Гликогенолиз – распад гликогена идет путем фосфоролиза.
- •Биосинтез углеводов.
- •Организационные принципы биосинтеза.
- •Фосфоенолпируват ббразуется из пирувата через оксалоацетат.
- •Вторая реакция гликолиза, которая не может использоваться для глюконеогенеза – это реакция фосфорилирования фру-6-ф, катализируемая фосфофруктокиназой.
- •Третьей обходной реакции в синтезе глюкозы является дефосфорилирование глю-6-ф с образованием глю.
- •Алкоголь тормозит глюконеогенез.
- •Окислительное декарбоксилирование пирувата.
- •Цикл трикарбоновых кислот.
- •Патология обмена углеводов.
- •Методы диагностики сахарного диабета.
- •Метод сахарной нагрузки.
- •Особенности обмена глюкозы в клетках опухали.
- •Гликогенозы.
- •Мышечные гликогенозы
- •Гемолитические анемии.
- •Особенности обмена углеводов в различных органах и тканях.
- •1. Обмен углеводов в печени.
- •Роль печени в обмене углеводов.
- •Обмен углеводов в мышцах.
- •Обмен углеводов в мышце.
- •Обмен углеводов в мозге.
- •Обмен углеводов в ткани мозга.
- •Обмен углеводов в эритроцитах.
- •Обмен углеводов в эритроцитах.
- •Регуляция обмена углеводов.
- •Концентрация метаболитов и глюкозы.
- •Воздействие гормонов. Внутриклеточные рецепторы.
- •Регуляция гликолиза.
- •Регуляция пируватдегидрогеназного комплекса.
- •Ингибирование продуктами реакции. Ацетил-КоА и надн ингибируют превращение
- •Регуляция нуклеотидами по принципу обратной связи.
- •Регуляция цтк.
- •2) Изоцитрат -оксоглутарат
- •3) Третьей регуляторной реакцией является реакция, катализируемая -кетоглутаратдегидрогеназой:
- •Регуляция цикла лимонной кислоты.
- •Активация пируваткарбоксилазы.
- •Гормональная регуляция обмена углеводов
- •Функции жирных кислот
- •Насыщенные жирные кислоты в основном энергетический материал (используются и как структурный материал).
- •Полинасыщенные жирные кислоты – эссенциальные соединения. Они не синтезируются в организме (линолевая) или синтезируются в недостаточном количестве.
- •Производные липидов
- •Транспорт липидов
- •Хиломикроны – самые крупные липопротеиды. Имеют низкую плотность (d 0,94 г/см3).Содержат 2% белка, 98% липиды, в основном триглицериды, которые поступают с пищей.
- •Функции аполипопротеинов:
- •Обмен триглицеридов.
- •Обмен триглицеридов.
- •Транспортные формы липидов.
- •Хиломикроны – крупные, рыхлые, 2% белка, 98% тг пищи.
- •Лпнп – 10-15% белка, 50% холестерина. Это основная транспортная форма холестерина и холестеридов.
- •Лпвп – 50% белка, остальные 50% распределены поровну между липидами.
- •Обмен триглицеридов.
- •Значение липидов в организме:
- •Липиды являются одним из компонентов клеточных мембран.
- •Липиды являются источником энергии для организма.
- •Липиды входят в состав водоотталкивающих и термоизоляционных покровов.
- •Переваривание и всасывание липидов
- •Ресинтез жиров в стенке кишечника
- •Промежуточный обмен липидов.
- •Внутриклеточный липолиз
- •Окисление жирных кислот.
- •Активация жирной кислоты происходит в митохондриальной мембране, где она катализируется ацил-КоА-синтетазой:
- •Перенос остатка жирной кислоты через мембрану митохондрий осуществляется карнитином:
- •Этапы -окисления
- •Расчет выхода энергии при окислении жирной кислоты
- •Окисление ненасыщенных жирных кислот
- •Окисление жирных кислот с нечетным числом углеродных атомов
- •Биосинтез жирных кислот
- •Механизм переноса ацетил – КоА через мембрану
- •Синтез ненасыщенных жирных кислот
- •Обмен и биологическое значение холестерина Переваривание и всасывание
- •Биосинтез холестерина
- •Регуляция биосинтеза холестерина
- •Транспорт холестерина
- •Судьба холестерина в клетке
- •Лнп с рецептором подвергается эндоцитозу и включается в лизосомы. Там лнп (аполипопротеиды, холестериды) распадаются. Хлороквин – ингибитор лизосомального гидролиза подавляет эти процессы.
- •Превращение холестерина в организме
- •Эстерификация холестерина
- •Окисление холестерина.
- •Окисление в монооксидазных системах печени и других органов
- •Экскреторные органы Моноокисдазная система.
- •Метаболизм кетоновых тел.
- •Холестерин в патологии.
Факторы, влияющие на активность ферментов.
Концентрация субстрата [S]
Концентрация фермента [F]
Температура
рН
Низкомолекулярные вещества (активаторы, ингибиторы).
Концентрация субстрата зависит от питания, возраста, физической нагрузки.
Зависимость скорости ферментативной реакции субстрата выражается уравнением Михаэлиса-Ментен:
![]()
Vmax – максимальная скорость реакции
[S] – концентрация субстрата
Km – константа Михаэлиса.
Анализ уравнения Михаэлиса-Ментен.
Концентрация субстрата мала, стремиться к нулю. При этих условиях [S] можно пренебречь:
[S] 0, при этом [S] можно пренебречь:
![]()
Концентрация субстрата стремится к бесконечности, пренебрегаем Km и уравнение имеет вид:
![]()
Сокращаем на [S] и скорость реакции равняется Vmax.
Если принять, что
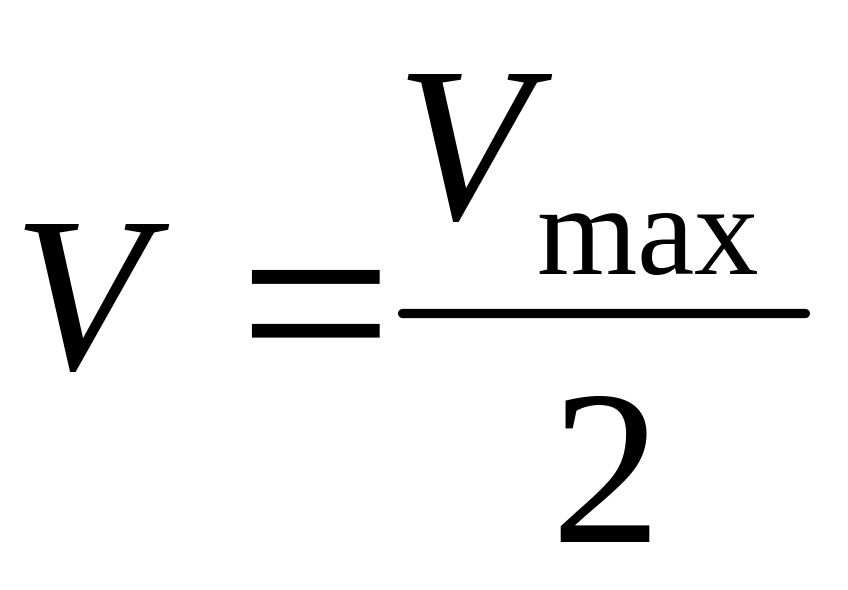 ,
то из уравнения Михаэлиса-Ментен,
разделив его на Vmax,
получили Km=[S]:
,
то из уравнения Михаэлиса-Ментен,
разделив его на Vmax,
получили Km=[S]:
![]() и
разделив на Vmax
получим
и
разделив на Vmax
получим
![]() .
Решая уравнение относительно Km
получаем Km+[S]
= 2[S],
.
Решая уравнение относительно Km
получаем Km+[S]
= 2[S],
Km=[S]
Km – величина, численно равная концентрации субстрата при , выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
Km показывает:
Степень сродства между ферментом и субстратом, существует обратная зависимость – чем меньше Km, тем больше сродство F к S.
Km позволяет определить какой субстрат будет превращаться под действием данного фермента:
Например, этиленгликоль – составная часть антифриза и алкагольдегидрогеназа (АДГ) будет превращать его в щавелевую кислоту, которая является ядом для печени.
Алкагольдегидрогеназа превращает этиловый спирт в уксусный альдегид и степень сродства АДГ к С2Н5ОН выше, чем к этиленгликолю и на этом основан способ нейтрализации этиленгликоля.
Km показывает степень сродства между белковой и небелковой частью F,

Km позволяет определить вид ингибирования.
Способ определения Km .
Построение график Михаэлиса-Ментен:

I участок – с увеличением концентрации субстрата увеличивается скорость ферментативной реакции
II участок – с увеличением концентрации субстрата скорость реакции не изменяется, т.к. все активные центры заняты.
Недостаток графика Михаэлиса-Ментен при определении Km заключается в том, что Vmax достигается с трудом, реакции в клетке протекают с оптимальной скоростью, а не Vmax.
Построение графика Лайнуэвера-Бэрка – метод обратных величин

Преимущество метода заключается в том, что прямую можно построить по двум точкам и нет необходимости определять максимальную скорость.
Зависимость скорости ферментативной реакции от концентрации фермента.
Зависимость
носит линейный характер. Скорость
химической реакции, катализируемой
данным ферментом прямопропорциональна
к онцентрации
фермента. При этом концентрация субстрата
величина постоянная. Это обясняетя
большим количеством активных центров
при определенном количестве молекул
субстрата
онцентрации
фермента. При этом концентрация субстрата
величина постоянная. Это обясняетя
большим количеством активных центров
при определенном количестве молекул
субстрата
