
- •Тема: Якісний аналіз
- •Література
- •Загальна характеристика катіонів і групи
- •Сірководнева класифікація катіонів
- •Кислотно – лужна класифікація катіонів
- •Аналітичні реакції катіонів і групи
- •Реакції катіонів і аналітичної групи
- •Хід аналізу суміші катіонів і групи
- •Аналіз суміші катіонів і групи
- •Катіони другої групи Загальна характеристика катіонів іі групи
- •Дія групового реактиву
- •Реакції катіонів іі аналітичної групи
- •Хід аналізу суміші катіонів II і і груп
- •1. Попередні дослідження
- •2. Відділення катіонів II групи від катіонів і групи
- •3. Розчинення осаду карбонатів
- •Аналіз суміші катіонів і і іі груп
- •Катіони третьої групи Загальна характеристика катіонів третьої групи
- •Дія групового реактиву
- •Аналітичні реакції на катіони третьої групи
- •Реакції катіонів ііі аналітичної групи
- •Катіони четвертої групи загальна характеристика катіонів четвертої аналітичної групи
- •Дія групових реактивів
- •Наліз суміші катіонів і і іv груп(без Cd I Bi )
- •Катіони п’ятої групи Загальна характеристика Катіонів п’ятої групи
- •К ласифікація аніонів
- •Аналітичні реакції іі групи
Реакції катіонів і аналітичної групи
Реактиви |
Na+ |
К+ |
NH4+ |
Mg2+ |
К[Sb(OH)6] |
білий кристалічний осад Na[Sb(OH)6] |
---- |
білий аморфний осад НSbО3 |
білий кристалічний осад Mg[Sb(OH)6]2 |
NaHC4H4O6 |
---- |
білий кристалічний осад KHC4H4O6 |
білий кристалічний осад NaHC4H4O6 |
---- |
Na[Co(NН2)6] |
---- |
жовтий кристалічний осад K2Na[Co(NО2)6] |
жовтий кристалічний осад (NН4)2Na[Co(NН2)6] |
---- |
КОН, NaOH |
---- |
---- |
виділення NН3 |
білий аморфний осад (MgOH)2 |
Реактив Несслера K2[HgI4] + KOH |
---- |
---- |
червоно-бурий осад [OHg2NH2)I] |
білий аморфний осад (MgOH)2 |
Na2HPO4 + NH4OH в присутності NН4Cl |
---- |
---- |
---- |
MgNH4PO4 |
Забарвлення полум’я |
жовтий |
фіолетовий |
---- |
---- |
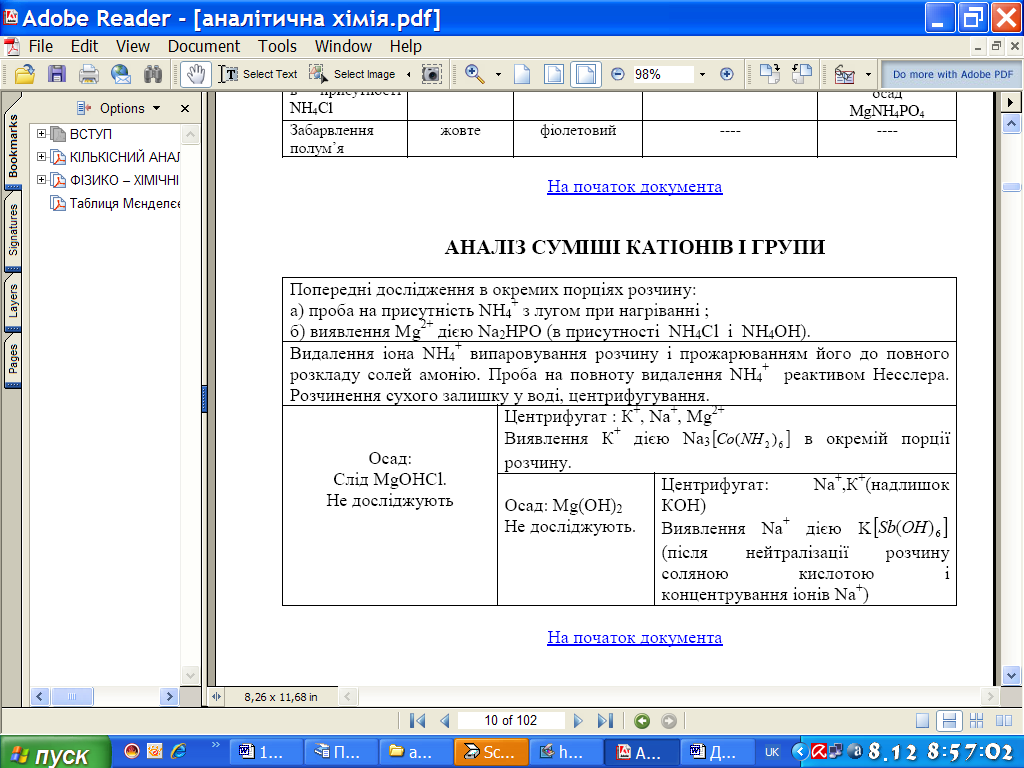
Хід аналізу суміші катіонів і групи
1. Виявлення катіона NH4+ - виявляється роздрібненим методом (інші катіони не заважають) - дією лугу або при нагріванні.
2. Виявлення катіона Nig2+ дією (Na2HPO4 + NH4OH).
3. Видалення катіона Н4+ який заважає виявленню Na+ і К+ - випарити в мікротипії і прожарити до повного розкладу солей NH4+. Коли припиниться виділення білого диму, крупинку осаду розчинити у воді і зробити пробу на повноту видалення NH4+ з реактивом Несслера. Після цього осад розчинити у воді, перенести в конічну пробірки і відцентрифугувати.
4. Виявлення К+:
за допомогою Na3[Co(NО2)6]
5. Видалення катіона Mg2+ - долити розчин КОН (не NaOH) до сильно лужної реакції і нагріти на водяній бані. Осад Mg(OH) відцентрифугувати.
6. Виявлення Na+:
Центрифугат налити в мікротигель, долити 2 н. розчину НС1 до кислої реакції, випарити досуха і прожарити. Після охолодження тигля розчинити сухий залишок в 2 - 3 краплях води і виявити Na+ дією K[Sb(OH)6].
Аналіз суміші катіонів і групи
Катіони другої групи Загальна характеристика катіонів іі групи
Загальна характеристика катіонів другої групи: Са2+, Sr2+, Ba2+.
Метали, що утворюють ці катіони, знаходяться в ІІ групі періодичної системи. Вони характеризуються високою хімічною активністю, що зростає від Са до Ва.
Катіони безбарвні і водних розчинів не забарвлюють. Ці катіони утворюють малорозчинні у воді карбонати, тому їх осаджують за допомогою (NH4)2CO3. З інших солей нерозчинні також сульфати, фосфати і оксалати, але у вигляді цих солей їх не осаджують, тому що сульфати важко перенести знову в розчин (нерозчинні в кислотах), а аніони РО43- і С2О42– ускладнюють аналіз.
Від катіонів 3 – 5 груп Са2+, Sr2+ і Ba2+ відрізняються доброю розчинністю сульфідів у воді.
Іони Са2+ широко поширені у природі, вони містяться у всіх живих організмах. Фосфат і карбонат кальцію входять до складу кісток.
Розчинний Са(НСО3)2 знаходиться в природних водах і надає їм тимчасової твердості.
Іони Ва2+ дуже отруйні.
