
- •1. Кинематика материальной точки.
- •2. Скорость и ускорение
- •3. Криволинейное движение тела
- •4. Динамика материальной точки. Законы Ньютона
- •5. Импульс тела
- •6. Импульс системы материальных точек.
- •8. Кинетическая и потенциальная энергия. Механическая энергия. Консервативные силы.
- •9. Закон сохранения механической энергии
- •10. Связь консервативной силы с потенциальной энергией
- •11. Центральный удар шаров. Абсолютно упругий удар.
- •12. Центральный удар шаров. Абсолютно неупругий удар. Частично неупругий удар. Коэффициент восстановления относительной скорости при ударе.
- •13. Кинематика вращательного движения. Угловая скорость, угловое ускорение. Связь с линейными величинами: линейной скоростью, тангенциальным(касательным) ускорением и нормальным ускорением.
- •14. Динамика вращательного движения. Момент силы. Момент инерции. Основное уравнение динамики вращательного движения.
- •15. Момент импульса. Закон сохранения момента импульса.
- •16.Кинетическая энергия вращающегося тела.
- •17.Движение в неинерциальных системах отсчета. Кинематика относительного движения.Абсолютные,Относительные,переносные скорости и ускорения, кориолисово ускорение.
- •18. Движение в неинерциальных системах отсчета. Динамика относительного движения. Основное уравнение деинаики относительного движения материальной точки.
- •19. Преобразование Галилея. Экспериментальные факты подтверждающие, теорию относительности.
- •20. Постулаты Эйнштейна. Преобразования Лоренца
- •Следствия из преобразований Лоренца
- •24. Релятивистский импульс
- •25. Релятивистское выражение для энергии.
- •26. Работа и теплота
- •27. Теплоёмкость идеального газа.Теплоёмкость при постоянном объёме и постоянном давлении.Уравнение Майера.
- •28. Теплоёмкости одноатомных и многоатомных газов
- •30. Изоэнтропийный процесс
- •31. Изотермический процесс
- •32. Обратимые и необратимые процессы.Энтропия.
- •33. Второе начало термодинамики.
- •34. Цикл Карно.
- •35.Основное уравнение кинетической теории газов.
- •37. Барометрическая формула. Распределение Больцмана.
- •38. Средняя длина свободного пробега молекул.
- •39. Явления переноса в газах. Диффузия.
- •40. Явление переноса. Элементарная теория диффузии.
- •41. Явления переноса. Теплопроводность газов.
- •42. Явления переноса. Вязкость газа.
- •43. Механические колебания. Свободные гармонические колебания.
- •44. Свободные затухающие колебания.
- •45. Вынужденные механические колебания.
- •46. Явление механического резонанса.
27. Теплоёмкость идеального газа.Теплоёмкость при постоянном объёме и постоянном давлении.Уравнение Майера.
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
Теплоёмкость ид.газа в изопроцессах:
Адиабатический
В
адиабатическом процессе теплообмена
с окружающей средой не происходит, то
есть ![]() .
Однако, объём, давление и температура
меняются, то есть
.
Однако, объём, давление и температура
меняются, то есть ![]() .Следовательно,
теплоемкость идеального газа в
адиабатическом процессе равна нулю:
.Следовательно,
теплоемкость идеального газа в
адиабатическом процессе равна нулю: ![]() .
.
Изотермический
В
изотермическом процессе постоянна
температура, то есть ![]() .
При изменении объема газу передается
некоторое количество тепла. Следовательно,
теплоемкость идеального газа стремится
к
.
При изменении объема газу передается
некоторое количество тепла. Следовательно,
теплоемкость идеального газа стремится
к
бесконечности: ![]()
Изохорный
В
изохорном процессе постоянен объем,
то есть ![]() .
Элементарная работа газа равна
произведению изменения объема на
давление, при котором происходит
изменение (
.
Элементарная работа газа равна
произведению изменения объема на
давление, при котором происходит
изменение (![]() ).
Первое Начало Термодинамики для
изохорного процесса имеет вид:
).
Первое Начало Термодинамики для
изохорного процесса имеет вид:
![]() А
для идеального газа
А
для идеального газа![]()
Таким
образом,
![]()
где ![]() —
число степеней свободы частиц газа.
—
число степеней свободы частиц газа.
Изобарный
В
изобарном процессе (![]() ):
):
![]()
CP=δQ/νΔT=CV+R=((i+2)/2)*R
Теплоемкость,
как и кол-во тепла, зависит от вида
теплового процесса. Различают теплоемкости
при постоянном давлении и постоянном
объеме. Если газ нагревается при
постоянном объеме, то работа внешних
сил равна нулю и сообщенная газу извне
теплота идет на увеличение его внутренней
энергии: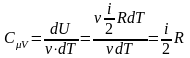 .
.
Используя первое начало термодинамики, можно показать, что молярная теплоемкость газа при постоянном объеме CV и молярная теплоемкость газа при постоянном давлении CP связаны соотношением
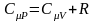 .
.
Это соотношение называется уравнением Майера.
28. Теплоёмкости одноатомных и многоатомных газов
Теплоёмкости
одноатомных газов СV
и СР
![]()
|
|
|
|
где теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит. Учитывая физический смысл R для изобарических процессов, можно записать:
|
|
|
|
Тогда теплоемкость при постоянном давлении для одноатомных газов:
|
|
или |
|
Полезно
знать соотношение:
![]()
|
|
|
|
где
γ - коэффициент
Пуассона, ![]()
Так
как ![]() , то
, то ![]() .
Из этого следует, что
.
Из этого следует, что
|
|
|
|
Кроме
того, ![]() ,
где i –
число степеней свободы молекул.
Подставив
в выражение для внутренней энергии,
получим:
,
где i –
число степеней свободы молекул.
Подставив
в выражение для внутренней энергии,
получим:
|
|
|
|
Так
как ![]() ,
то внутреннюю
энергию можно найти по формуле
,
то внутреннюю
энергию можно найти по формуле![]()
|
Теплоемкости
многоатомных газов
Опыты
с двухатомными газами, такими как азот,
кислород и др., показали, что![]()
Для
водяного пара и других многоатомных
газов
![]()
|
|
|
|
Таким образом, молекулы многоатомных газов нельзя рассматривать как материальные точки. Необходимо учитывать вращательное движение молекул и число степеней свободы этих молекул. Числом степени свободы (i) называется число независимых переменных, определяющих положение тела в пространстве. Положение одноатомной молекулы, как и материальной точки, задаётся тремя координатами, поэтому она имеет три степени свободы. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два независимых вращения, а любое вращение можно разложить на три вращательных движения вокруг взаимно перпендикулярных осей. Но для двухатомной молекулы вращение вокруг её собственной оси не изменит её положение в пространстве, а момент инерции относительно этой оси равен нулю (рис. 4.3). Таким образом, у двухатомных молекул пять степеней свободы (i = 5), а у трёхатомных шесть степеней свободы (i = 6).При взаимных столкновениях молекул возможен обмен их энергиями и превращение энергии вращательного движения в энергию поступательного движения и обратно. Таким путём было установлено равновесие между значениями средних энергий поступательного и вращательного движения молекул. Больцман доказал, что для не слишком низких температур средняя энергия <K>, приходящаяся на одну степень свободы, равна ½ Kt
29. pv-диаграммы.Изобарный и изохорный процессы
Изобарный
При изобарическом процессе, давление в газе остается неизменным (Δp = 0). Объем идеального газа при изобарном процессе пропорционален температуре V/T=const.
Изобарный процесс можно описать уравнением:
V = VoαT, где
V – объем газа при абсолютной температуре Т;
Vo — объем газа при температуре 0оС;
α — температурный коэффициент объемного расширения газа, равный 1/273 К-1
Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: Q = ΔH = ΔU + PΔV.
Молярная теплоёмкость при постоянном давлении обозначается как Cp. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
Cp = Cv + R.где
R - универсальная газовая постоянная - R=8.31 (Дж/(моль*К))
Энтропия процесса
Изменение энтропии при квазистатическом (идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия) изобарном процессе равно:
![]() где
где
H, H1, H2 - энтальпия
dS - изменение энтропии
Изохорный
Изохорный процесс
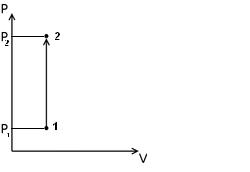
Изохорный процесс происходит при постоянном объёме, при этом давление идеального газа прямо пропорционально его температуре
p/T=const.
Работу в этом процессе газ не совершает (т.к ΔV=0), соответственно Q= ΔU
Уравнение изохорного процесса (уравнение Шарля) может быть записано в виде:
p=Tp0/T0=p0αT где
p0 – давление газа при T = T0 = 273 К
α — температурный коэффициент объемного расширения газа, равный 1/273 К-1
Энтропия процесса
Т.к. в системе при изохорном процессе происходит теплообмен с внешней средой, то, соответственно, происходит изменение энтропии. Из определения энтропии следует:
![]() где
где
dS - изменение энтропии
dQ - изменение энергии
