
- •27. Принцип действия компрессора теоретическая диаграмма сжатия в компрессоре
- •29. Эффект Джоуля-Томсона и его объяснения
- •30. Изобарный процесс водяного пара
- •31. Основное уравнение газового потока и его анализ
- •34. Дросселирование газов и паров
- •35. Определение изменения внутренней энергии и энтальпии политропный процесс
- •36. Влажный воздух основные характеристики принцип действия психрометра
- •37. Энтальпия, первый закон термодинамики через энтальпию
- •38. Определение холодильного коэффициента в воздушной холодильной установке
1. Уравнения Менделеева-Клайперона
PV = nRT
где n – число молей газа; P – давление газа (например, в атм; V – объем газа (в литрах);T – температура газа (в кельвинах);R – газовая постоянная (0,0821 л·атм/моль·K)
25. Внутренняя энергия и работа изменения объёма работы рабочего тела
Рабочее тело характеризуют различные параметры состояния – давление, объем, температура, внутренняя энергия, энтальпия, т.д. В качестве основных параметров состояния принимают: удельный объём, абсолютное давление и абсолютную температуру.
Удельным
объёмом называется объём единицы
массы вещества:
![]() ,
м3/кг.
,
м3/кг.
Масса
единицы объёма, т.е. величина обратная
удельному объему, называется плотностью:
![]() ,
кг/м3.
,
кг/м3.
Внутренняя энергия складывается из внутренних кинетической и потенциальной энергий. Внутренняя кинетическая энергия создается хаотическим движением молекул вещества.
Кинетическая
энергия всей макросистемы вычисляется:![]()
где m– масса системы;w– скорость ее движения в пространстве.
Силы взаимодействия молекул вещества друг с другом определяют внутреннюю потенциальную энергию тела.
Внутренней энергией называется такая энергия, которая заключена в самой системе и имеет две составляющие – кинетическую энергию.
Изменение удельной потенциальной (внутренней) энергии того же тела. Изменение всей удельной (внутренней) энергии при термодинамическом процессе будет выглядеть так:
u – Uk– ир.
Внутренняя энергия рабочего тела произвольной массы при этом рассчитывается по формуле:
v-Vk – Vp.
Предположим, что рабочее тело переходит из первого состояния во второе при подводе теплоты извне. Тогда количество этой теплоты выразится в виде:
q1,2 – u2 -U1.
Процесс проходит по изохорному закону, имеем:
q1,2 = cv (T2 -T1).
В общем виде для любого вещества массой m:
v2 -v1 – mcv(T2– T1),
где T1 – начальная температура термодинамического процесса;T2– конечная температура;u1 – начальная величина внутренней энергии;u2 – конечная величина внутренней энергии;c– средняя удельная теплоемкость (изохорная).
26. Определение средней теплоёмкости по истиной
Теплоемкостью тела называется количество тепла, необходимое для нагрева тела на один градус.
Теплоемкость
единицы количества вещества называют
удельной теплоемкостью. В зависимости
от того, в каких единицах задано количество
вещества, в расчетах используют следующие
удельные теплоемкости:
– массовую
теплоемкость с,
отнесенную к 1 кг массы, Дж/(кг∙K);
–
объемную теплоемкость с',
отнесенную к количеству вещества,
которое содержится в 1м3
при нормальных физических условиях,
Дж/(м3∙К);
–
молярную теплоемкость μс,
отнесенную к 1 кмоль вещества,
Дж/(м3∙К).
Удельная
теплоемкость является уже интенсивным
свойством, т.е. ее величина не зависит
от количества вещества в системе. Часто
удельную теплоемкость для краткости
называют просто теплоемкостью.
Теплоемкость
тела зависит от температуры и давления.
Для идеальных газов влиянием давления
можно пренебречь, то есть считать с=f(T).
Различают истинную теплоемкость
![]()
![]() (1)
и
среднюю в некотором интервале
температур
(1)
и
среднюю в некотором интервале
температур
![]() (2)
Здесь
q
– количество тепла, сообщенное 1 кг
вещества.
Средняя изобарная
теплоемкость в интервале температур
подсчитывается по табличным данным
так
(2)
Здесь
q
– количество тепла, сообщенное 1 кг
вещества.
Средняя изобарная
теплоемкость в интервале температур
подсчитывается по табличным данным
так
 ,
где
значения
,
где
значения
![]() ,
,
![]() берутся
из таблиц теплоемкостей вещества.
Теплоемкость
зависит от характера термодинамического
процесса, при котором подводится или
отводится теплота, поэтому при
экспериментальном определении ее
значения обычно используют два
термодинамических процесса, протекающих
при постоянном объеме (теплоемкость
сv)
и давлении (теплоемкость ср).
Значения этих теплоемкостей для различных
веществ сведены в таблицы. Изобарная
теплоемкость больше изохорной на
величину работы, совершаемой 1 кг газа
в изобарном процессе при нагреве его
на 1 К. Для идеальных газов связь между
ср
и сv
устанавливается соотношением Майера
берутся
из таблиц теплоемкостей вещества.
Теплоемкость
зависит от характера термодинамического
процесса, при котором подводится или
отводится теплота, поэтому при
экспериментальном определении ее
значения обычно используют два
термодинамических процесса, протекающих
при постоянном объеме (теплоемкость
сv)
и давлении (теплоемкость ср).
Значения этих теплоемкостей для различных
веществ сведены в таблицы. Изобарная
теплоемкость больше изохорной на
величину работы, совершаемой 1 кг газа
в изобарном процессе при нагреве его
на 1 К. Для идеальных газов связь между
ср
и сv
устанавливается соотношением Майера
![]() ,
(3)
где R –
газовая постоянная (например, для воздуха
R=287
Дж/(кг∙К)).
Теплоемкость газов в
отличие от твердых тел и жидкостей в
сильной степени зависит от характера
процесса подвода или отвода тепла.
,
(3)
где R –
газовая постоянная (например, для воздуха
R=287
Дж/(кг∙К)).
Теплоемкость газов в
отличие от твердых тел и жидкостей в
сильной степени зависит от характера
процесса подвода или отвода тепла.
27. Принцип действия компрессора теоретическая диаграмма сжатия в компрессоре
Сжатие происходит по следующему циклу (см. рис. 1). Когда поршень перемещается из верхней мёртвой точки – давление в зоне сжатия снижается ниже давления всасывания (точка 4). Впускной клапан открывается и воздух из всасывающей области поступает в зону сжатия. Поршень в этот момент перемещается вверх и давление в зоне сжатия возрастает. Как только оно превысит давление всасывания, впускной клапан закрывается (точка 1). Давление продолжает расти до тех пор, пока не превысит давления нагнетания (точка 2). Выпускной клапан открывается, и сжатый воздух дух поступает в линию нагнетания вплоть до достижения поршнем верхней мёртвой точки. При завершающем ходе поршня вниз, давление в цилиндре очень быстро понижается и выпускной клапан снова закрывается (точка 3)

28. Дросселирование водяного пара, особенности процесса
Для водяного пара критическая температура составляет Тк = 647 К, соответственно, Тинв > 4400 К (температура инверсии). В процессе дросселирования всегда происходит охлаждение водяного пара, это связано с полной диссоциацией молекул пара при таких не очень высоких значениях данной температуры инверсии.Дросселирование водяного пара характеризуется следующими свойствами, полученными из анализа диаграммы (i, s):
1) для любого состояния пара дросселирование всегда понижает температуру водяного пара;
2) дросселирование влажных паров при небольших давлениях сопровождается переходом из увлажненного в сухое, а затем в перегретое состояние. Влажные пары при высокихдавленияхсначала еще более увлажняются, но потом такжеобразуют сухую и перегретую фазу;
3) дросселирование перегретых паров при больших давлениях (если температура перегрева невелика) сопровождается прохождением ими несколькихфаз (сухого насыщенного, влажного, сухого и наконец, перегретого). Последнее состояние пара характеризуется низкими значениями температуры и давления. В общем случае при дросселировании перегретые пары сохраняют свое перегретое состояние, если в начале процесса их давления были высокими.
Обычно на is-диаграмме процесс дросселирования i1 = i2 представляет собой горизонтальную линию, направленную в сторону возрастания энтропии (вследствие необратимости процесса).
Известно, что давление перегретого пара (и его полезная работа) в процессе мятия снижается.
аад < aдрос, где адрос - температурный эффект адиабатного необратимого расширения (т. е. дросселирования), а аад– эффект адиабатного обратимого расширения. Отсюда при одном давлении dp имеем:
dTдрос < dTад на величину v/cp.

|
|
|
|
||
|
||
29. Эффект Джоуля-Томсона и его объяснения
Эффе́ктом Джоуля — То́мсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
Изменение
энергии газа в ходе этого процесса будет
равно работе:
![]()
Изменение
температуры при малом изменении давления
(дифференциальный
эффект) в
результате процесса Джоуля — Томсона
определяется производной
 ,
называемой коэффициентом
Джоуля — Томсона.
С помощью элементарных преобразований
можно получить выражение для этого
коэффициента:
,
называемой коэффициентом
Джоуля — Томсона.
С помощью элементарных преобразований
можно получить выражение для этого
коэффициента:
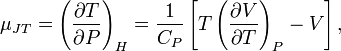
где
![]() —
теплоёмкость
при постоянном давлении. Для идеального
газа
—
теплоёмкость
при постоянном давлении. Для идеального
газа
![]() ,
а для реального газа он определяется
уравнением
состояния.Если
при протекании газа через пористую
перегородку температура возрастает
(
,
а для реального газа он определяется
уравнением
состояния.Если
при протекании газа через пористую
перегородку температура возрастает
(![]() ),
то эффект называют отрицательным,
и наоборот, если температура убывает
(
),
то эффект называют отрицательным,
и наоборот, если температура убывает
(![]() ),
то процесс называют положительным.
Температуру, при которой
),
то процесс называют положительным.
Температуру, при которой
![]() меняет
знак, называют температурой
инверсии.
меняет
знак, называют температурой
инверсии.
