
- •Часть III
- •Оглавление
- •13.1. Физические свойства 33
- •Часть III. Функциональные производные углеводородов
- •Виды некоторых классов органических соединений и названия их функциональных групп для [м.Н.]
- •Глава 10. Спирты и фенолы (оксисоединения)
- •10.1. Алканолы (Алкоголи)
- •10.1.1. Общая характеристика
- •10.1.2. Физические свойства спиртов
- •10.1.3. Химические свойства спиртов
- •10.1.4. Получение и применение спиртов
- •10.2. Многоатомные спирты (полиолы)
- •10.3. Фенолы
- •Контрольные вопросы и задания
- •Глава 11. Альдегиды и кетоны (оксосоединения)
- •11.1. Изомерия и номенклатура оксосоединений
- •11.2. Физические свойства оксосоединений
- •11.3. Химические свойства
- •11.4. Получение и применение оксосоединений
- •Контрольные вопросы и задания
- •Глава 12. Карбоновые кислоты
- •Некоторые карбоновые кислоты
- •12.1. Физические свойства
- •12.2. Химические свойства
- •12.3. Получение и применение карбоновых кислот
- •Контрольные вопросы и задания
- •Глава 13. Сложные эфиры и жиры
- •13.1. Физические свойства
- •13.2. Химические свойства
- •13.3. Жиры
- •13.4. Применение и получение сложных эфиров
- •Контрольные вопросы и задания
- •Глава 14. Углеводы
- •14.1. Моносахариды (м/с)
- •14.1.1. Циклизация моносахаридов
- •14.1.2. Химические свойства моносахаридов
- •14.2. Дисахариды (д/с)
- •14.3. Полисахариды (п/с)
- •14.4. Получение и применение углеводов
- •Контрольные вопросы и задания
- •Глава 15. Азотосодержащие органические соединения
- •15.1. Амины
- •В торичные амины:
- •Т ретичные амины:
- •П олиамин: Ароматический амин:
- •15.2. Аминокислоты
- •Некоторые -аминокислоты
- •15.3. Белки
- •Контрольные вопросы и задания
- •Список литературы
- •Андрей Вениаминович Скворцов Органическая химия 10 Учебное пособие
- •630092, Г. Новосибирск, пр. К. Маркса, 20
10.1.4. Получение и применение спиртов
В свободном виде спирты в природе встречаются в небольших количествах.
Получают спирты:
а) щелочным гидролизом алкилгалогенидов (замещением галогена на гидроксил); сравним с действием на алкилгалогениды спиртового раствора щелочи:
N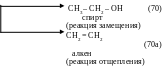 aOH
(водн.)
aOH
(водн.)
(– NaBr)
CH3 – CH2 – Br
галогенид NaOH (спирт.)
(– НBr)
б) гидратацией алкенов (присоединением воды в присутствии минеральных кислот):
 (t°C)
(t°C)
C H3
– CH
= CH2
+ H–OH → CH3 –
CH –
CH3
(71)
H3
– CH
= CH2
+ H–OH → CH3 –
CH –
CH3
(71)
(H+) │
[Пропен] OH
[Пропанол 2]
в) гидрированием (восстановлением) альдегидов и кетонов (см. дальше, реакции 85 и 86).
Получение спиртов в промышленности – многотоннажные производства.
Метанол (около 20 млн т/год) получают при гидролизе древесины и из синтез-газа:
t°C; давл;
СО + 2Н2 → CH3 – OH (72)
Katal
Идет на производство формальдегида, оргстекла; используется как растворитель и как топливо для ДВС.
Этанол (около 3 млн т/год) технический получают гидратацией этилена водяным паром, а медицинский – брожением углеводов (см. дальше, реакцию 123). Используется для получения ацетальдегида и уксусной кислоты, дивинила (и далее – каучука и резины – см. реакцию 29), как растворитель лекарств и в ликероводочной промышленности.
Вторбутанол (около 850 тыс. т/год) – основной компонент тормозных жидкостей для автомобилей.
10.2. Многоатомные спирты (полиолы)
Многоатомные спирты содержат в одной молекуле несколько гидроксилов у разных атомов углерода:
H2C – CH2 H2C – CH – CH2
│ │ │ │ │
OH OH OH OH OH
этиленгликоль глицерин
[этандиол – 1,2] [пропантриол – 1,2,3]
Это вязкие сиропообразные жидкости, без цвета и запаха, хорошо растворимые в воде, имеющие плотности, соответственно –1,11 и 1,26 г/мл.
По химическим свойствам схожи с обычными (одноатомными) спиртами: реагируют со щелочными металлами, внутри- и межмолекулярно дегидратируются, образуют сложные эфиры с кислотами.
Отличие полиолов в том, что они могут образовывать моно-, ди- и тризамещенные продукты (по количеству прореагировавших гидроксилов).
Качественной для многоатомных спиртов является их реакция со свежеосажденным гидроксидом меди (II): светло-голубой осадок Cu(OH)2 растворяется в многоатомном спирте с образованием раствора ярко-синего цвета:

C H2
–O H + HO CH2
–O
H2
–O H + HO CH2
–O
│ Cu → Cu (73)
C H2
–O H HO (–2H2O)
CH2 –O
H2
–O H HO (–2H2O)
CH2 –O
этиленгликоль гликолят меди (II)
О чень
важными являются реакции образования
сложных эфиров глицерина с карбоновыми
кислотами и с HNO3:
чень
важными являются реакции образования
сложных эфиров глицерина с карбоновыми
кислотами и с HNO3:
О
CH2 –O – NO2 CH2 –OH О CH2 –O –C –R
│ 3HО–NO2 │ 3HO–C–R │ О
CH –O – NO2 ← CH –OH → CH –O –C –R (74)
│ (–3H 2O) │ (–3H2O) │ О
CH2 –O – NO2 CH2 –OH CH2 –O –C –R
нитроглицерин глицерин жир1]
Нитроглицерин – взрывчатое вещество (входит в состав динамита), при ударе, трении, от электрической искры взрывается с выделением большого количества газов:
4C3H5(ONO2)3 → 12CO2 + 6N2 + 10H2O + O2 (75)
Глицерин и этиленгликоль очень широко используются в различных областях: в медицине и парфюмерии (кремы и мази), в консервной промышленности, при изготовлении синтетических волокон (лавсан) и пластмасс (целлофан, полиуретаны, глифталевые смолы и др.); входят в состав антифризов.
