
- •Часть III
- •Оглавление
- •13.1. Физические свойства 33
- •Часть III. Функциональные производные углеводородов
- •Виды некоторых классов органических соединений и названия их функциональных групп для [м.Н.]
- •Глава 10. Спирты и фенолы (оксисоединения)
- •10.1. Алканолы (Алкоголи)
- •10.1.1. Общая характеристика
- •10.1.2. Физические свойства спиртов
- •10.1.3. Химические свойства спиртов
- •10.1.4. Получение и применение спиртов
- •10.2. Многоатомные спирты (полиолы)
- •10.3. Фенолы
- •Контрольные вопросы и задания
- •Глава 11. Альдегиды и кетоны (оксосоединения)
- •11.1. Изомерия и номенклатура оксосоединений
- •11.2. Физические свойства оксосоединений
- •11.3. Химические свойства
- •11.4. Получение и применение оксосоединений
- •Контрольные вопросы и задания
- •Глава 12. Карбоновые кислоты
- •Некоторые карбоновые кислоты
- •12.1. Физические свойства
- •12.2. Химические свойства
- •12.3. Получение и применение карбоновых кислот
- •Контрольные вопросы и задания
- •Глава 13. Сложные эфиры и жиры
- •13.1. Физические свойства
- •13.2. Химические свойства
- •13.3. Жиры
- •13.4. Применение и получение сложных эфиров
- •Контрольные вопросы и задания
- •Глава 14. Углеводы
- •14.1. Моносахариды (м/с)
- •14.1.1. Циклизация моносахаридов
- •14.1.2. Химические свойства моносахаридов
- •14.2. Дисахариды (д/с)
- •14.3. Полисахариды (п/с)
- •14.4. Получение и применение углеводов
- •Контрольные вопросы и задания
- •Глава 15. Азотосодержащие органические соединения
- •15.1. Амины
- •В торичные амины:
- •Т ретичные амины:
- •П олиамин: Ароматический амин:
- •15.2. Аминокислоты
- •Некоторые -аминокислоты
- •15.3. Белки
- •Контрольные вопросы и задания
- •Список литературы
- •Андрей Вениаминович Скворцов Органическая химия 10 Учебное пособие
- •630092, Г. Новосибирск, пр. К. Маркса, 20
15.3. Белки
Аминокислоты, пептиды и белки (протеины) образуют группу химически и биологически родственных соединений, которым принадлежит важнейшая роль в жизненных процессах.
Белки – природные биополимеры. Они являются высшей формой развития органического мира и участвуют во всех процессах функционирования живой природы.
Простые белки (протеины) образуются конденсацией -аминокислот (см. табл. 12), остатки которых соединяются между собой пептидными связями, т.е. белки – полипептиды. В гидролизатах природных белков обнаружено 20 видов аминокислот, 8 из которых являются незаменимыми, т.е. не могут синтезироваться организмом человека и должны поступать в него в готовом виде (с пищей).
Белки имеют сложную структуру. Различают три уровня организации структуры белков – первичную, вторичную и третичную структуры.
Первичная структура белка – химическое строение – вид аминокислот и порядок их чередования в полипептидной цепи. Полимерная цепь белковой молекулы «набирается» из аминокислот, как слово из букв. И так же, как при перестановке пары букв в слове меняется его лингвистический смысл (например, «кто» и «кот»), при перестановке аминокислот в первичной структуре пептида изменится его биологическая функция.
O H O H
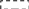
 ║ │ ║
│
║ │ ║
│
H 2N─CH─C─OH
+ H─N─CH─C─OH + H─N─CH─COOH
2N─CH─C─OH
+ H─N─CH─C─OH + H─N─CH─COOH
│ │ │
СH3 СH2OH (СH2)4─NH2
аланин серин лизин
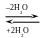
 O
H O
H
O
H O
H
[147]
H2N ─ CH ─ C ─ N ─ CH ─ C ─ N ─ CH ─ COOH (143)
│ │ │
(Н+)
трипептид (ала)(сер)(лиз)
Организм для своих биосинтезов использует аминокислоты.
Гидролиз – расщепление водой пептидов (белков) на молекулы аминокислот – процесс противоположный процессу образования белков (реакция 143 справа налево). В организмах процесс гидролиза идет под действием гидролизат-ферментов, в лаборатории – под действием кислот или щелочей.
В случае щелочного гидролиза белков (пептидов) образуются соли аминокислот – процесс уже необратимый (в отличие от реакции 143).
O H O H

 ║ │ ║ │
4NaOH
║ │ ║ │
4NaOH
H 2N
─ CH ─ C ─ N ─ CH ─ C ─ N ─ CH ─ COOH +
2N
─ CH ─ C ─ N ─ CH ─ C ─ N ─ CH ─ COOH +
│ │ │ (–2H2O)
СH3 (H2C)2 ─ COOH (CH2)4 ─ NH2
(ала) (глу) (лиз)
(144)
H2N ─ CH ─ COONa + H2N ─ CH ─ COONa + H2N ─ CH ─ COONa
│ │ │
CH3 (H2C)2 COONa (CH2)4 ─ NH2
(аланат Na) (глутамат Na) (лизинат Na)
Вторичная структура белка – пространственное строение – диаметр (d) и шаг () цилиндрической спирали, в которую «закручена» полипептидная цепь (рис. 22, а). Зафиксирована вторичная структура белковой молекулы внутримолекулярными водородными связями, возникающими между близко расположенными атомами кислорода (С=О)-групп и атомами водорода (N–H)-групп (›C=O…H–N‹) (пример образования межмолекулярных водородных связей – см. п. 10.1.2).
d

• • •
… … …
• •
• •
• •
• •
• •
O=C
C=O
а б
Рис. 22. Вторичная (а) и третичная (б) структуры белка; многоточием показаны водородные связи, фиксирующие пространственное строение молекулы белка
Третичная структура белка – пространственное строение (рис. 22, б) – это «укладка» в пространстве «закрученной» в спираль полипептидной цепи белковой молекулы в глобулы (подобно укладке гибкой проволочной спирали в гнездах электроплитки). И здесь фиксация пространственной структуры осуществляется водородными связями (как и в случае вторичной структуры).
Водородные связи, фиксирующие вторичную и третичную структуры белка, непрочны. Они сравнительно легко разрываются воздействиями на белок температуры, жестких излучений, значительных изменений рН раствора. В результате разрыва внутримолекулярных водородных связей изменяется пространственная структура белковой молекулы, т. е. вторичная и третичная.
Этот процесс называется денатурация белка. В зависимости от масштабов нарушения пространственного строения белка ослабевает или вообще исчезает биологическая функция белка. Пример денатурации белка – варка куриного яйца.
