
- •Часть III
- •Оглавление
- •13.1. Физические свойства 33
- •Часть III. Функциональные производные углеводородов
- •Виды некоторых классов органических соединений и названия их функциональных групп для [м.Н.]
- •Глава 10. Спирты и фенолы (оксисоединения)
- •10.1. Алканолы (Алкоголи)
- •10.1.1. Общая характеристика
- •10.1.2. Физические свойства спиртов
- •10.1.3. Химические свойства спиртов
- •10.1.4. Получение и применение спиртов
- •10.2. Многоатомные спирты (полиолы)
- •10.3. Фенолы
- •Контрольные вопросы и задания
- •Глава 11. Альдегиды и кетоны (оксосоединения)
- •11.1. Изомерия и номенклатура оксосоединений
- •11.2. Физические свойства оксосоединений
- •11.3. Химические свойства
- •11.4. Получение и применение оксосоединений
- •Контрольные вопросы и задания
- •Глава 12. Карбоновые кислоты
- •Некоторые карбоновые кислоты
- •12.1. Физические свойства
- •12.2. Химические свойства
- •12.3. Получение и применение карбоновых кислот
- •Контрольные вопросы и задания
- •Глава 13. Сложные эфиры и жиры
- •13.1. Физические свойства
- •13.2. Химические свойства
- •13.3. Жиры
- •13.4. Применение и получение сложных эфиров
- •Контрольные вопросы и задания
- •Глава 14. Углеводы
- •14.1. Моносахариды (м/с)
- •14.1.1. Циклизация моносахаридов
- •14.1.2. Химические свойства моносахаридов
- •14.2. Дисахариды (д/с)
- •14.3. Полисахариды (п/с)
- •14.4. Получение и применение углеводов
- •Контрольные вопросы и задания
- •Глава 15. Азотосодержащие органические соединения
- •15.1. Амины
- •В торичные амины:
- •Т ретичные амины:
- •П олиамин: Ароматический амин:
- •15.2. Аминокислоты
- •Некоторые -аминокислоты
- •15.3. Белки
- •Контрольные вопросы и задания
- •Список литературы
- •Андрей Вениаминович Скворцов Органическая химия 10 Учебное пособие
- •630092, Г. Новосибирск, пр. К. Маркса, 20
13.2. Химические свойства
«Главное» свойство сложных эфиров – их способность к гидролизу, который в живой природе идет под каталитическим действием ферментов, а в технике – в присутствии минеральных кислот или щелочей – омыление.


O +НО–Н О
R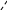




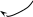 –
С R– С
+ R1–ОН
(111)
–
С R– С
+ R1–ОН
(111)
O–R1 (Н+) ОН
сложный эфир кислота спирт
Кислотный гидролиз сложных эфиров – обратимый процесс.
O +NaOH O
+NaOH O
R
 –
С R– С
+ R1–ОН
(112)
–
С R– С
+ R1–ОН
(112)
O–R1 (H2O) ОNa
сложный эфир соль спирт
Омыление – необратимый процесс, так как образующаяся при гидролизе кислота нейтрализуется щелочью.
13.3. Жиры
Особую группу сложных эфиров составляют жиры – сложные эфиры глицерина и жирных карбоновых кислот.
В природных жирах встречается около 300 видов кислот. Наиболее распространенными из них являются:
а) насыщенные – пальмитиновая С15Н31СООН и стеариновая С17Н35СООН;
б) ненасыщенные – олеиновая С17Н33СООН, линолевая С17Н31СООН и леноленовая С17Н29СООН, с одной (ен-9), двумя (диен-9,12) и тремя (триен-9,12,15) двойными связями в неразветвленной С-цепи соответственно.
Наряду с высшими (жирными) кислотами в состав жиров могут входить и низшие кислоты (например, масляная – до 5 % в молочном жире, откуда впервые и была выделена). Именно образованием масляной кислоты обусловлен неприятный запах прогорклого сливочного масла.
О
CH2
– O – C(O) – R1 │ CH
– O – C(O) – R2 │ CH2
– O – C(O) – R3
По происхождению жиры делятся на две группы:
а) животные жиры с участием в основном насыщенных кислот; это твердые жиры;
б) растительные масла, содержащие в основном непредельные кислоты – жидкие жиры.
Жиры – пищевой продукт большой энергетической ценности для организма, а также исходное сырье для получения глицерина, жирных карбоновых кислот и мыла:
CH2
– O – C(O)
– С17Н35 CH2
– OН │
+3Н2О
│ CH
– O – C(O)
– С17Н35 →
CH – OН
+ 3С17Н35СООН (113) │
(Н+)
│ CH2
– O – C(O)
– С17Н35 CH2
– OН
(тристеарат
глицерина) (глицерин) (стеариновая
кислота)
CH2
– O – C(O)
– С17Н35 CH2
– OН │
+3NaOН
│ CH
– O – C(O)
– С17Н35 →
CH – OН +
3С17Н35СООNa
(114) │
(Н2О)
│ CH2
– O – C(O)
– С17Н35 CH2
– OН мыло
(тристеарат
глицерина) (глицерин) (стеарат
натрия)
Соли жирных кислот и щелочных металлов являются мылами. Мыла обладают моющими свойствами, так как способны эмульгировать жиры и масла, т.е. переводить их в мельчайшие капли, смачиваемые водой (в отличие от самих жиров). Мыла нельзя использовать в жесткой воде, содержащей ионы Са+2 и Mg+2 , так как Са и Mg дают соли жирных кислот, нерастворимые в воде.
Химическая суть превращения растительных масел в твердые жиры (маргариновая промышленность) – гидрогенизация масел, т.е. насыщение водородом остатков непредельных кислот в составе масел:
CH2
– O – C(O)
– С17Н29 CH2
– O – C(O)
– С17Н35 │
+5Н2 │ CH
– O – C(O)
– С17Н31 → CH
– O – C(O)
– С17Н35 (115) │
(Ni)
│ CH2
– O – C(O)
– С17Н35 CH2
– O – C(O)
– С17Н35 (жидкий
жир) (твердый жир)
Важная область применения жидких растительных масел (высыхающих) – изготовление олифы и масляных красок.
