
- •Перспективы создания энерго-хим-технолог системы (эхтс)
- •Техническая термодинамика. Основные понятия термодинамической системы.
- •Уравнение состояния идеальных газов.
- •Смеси газов.
- •Реальные газы
- •Первый закон термодинамики.
- •Теплота. Тепловая диаграмма т-s.
- •Теплоемкость, энтальпия,энтропия.
- •Энтальпия.
- •Энтропия
- •Первый закон термодинамики для стандартного потока газа.
- •Термодинамические процессы изменения состояния идеального газа.
- •Адиабатный процесс.
- •Политропный процесс.
- •Формулировки 2-го закона термодинамики.
- •Циклы Карно. Прямой обратимый цикл Карно.
- •Обратный обратимый цикл Карно.
- •Максимальная работа и потеря полезной энергии. Эксергия.
- •Эксергетический метод термодинамического анализа эхтс.
- •Виды эксергии.(Чечеткин а.В.С.73)
- •Ящик Грассмана
- •1. Эхтс.
- •Компрессоры.
- •Степень сжатия.
- •Промышленные способы получения тепла.
- •Химическое топливо.
- •Состав и основные характеристики жидкого топлива
- •Состав и основные характеристики газообразного топлива
- •Теплота сгорания топлива.
- •Искуственное охлаждение.
- •Процессы умеренного охлаждения. Компрессионные холодильные установки. Идеальный цикл. Основные показатели.
- •Газокомпрессионная холодильная машина
- •Изображение цикла на p – V и t – s диаграммах.
- •Глубокое охлаждение.
- •Термокомпрессор
Уравнение состояния идеальных газов.
Уравнение, выражающее связь между параметрами равновесного состояния термодинамической системы идеального газа.
Уравнение состояния идеального газа впервые было получено Клапейроном путем объединения уравнений законов Бойля-Мариотта и Гей-Люссака pν/T=const. Обозначая константу через R, получим уравнение для 1 кг газа.
Pν = RT, |
(1) |
где R –удельная газовая постоянная, отнесенная к массе газа, Дж/кг·К.
P- абсолютное давление, Па=Н/м2,
T – абсолютная температура газа. К,
ν - удельный объем газа,м3/кг
Учитывая, что плотность газа ρ = 1/ ν перепишем уравнение (1)
Р = ρ RT |
(2) |
где ρ – плотность газа, кг/м3.
Умножая обе части уравнения (1) на массу газа м, получим уравнение состояния для м кг газа, где м не равно 1.
РV = m RT (m≠1) (3)
где – Р- абсолютное давление, Па=Н/м2,
V – объем м кг газа, м3,
m – масса газа, кг,
R –удельная газовая постоянная, отнесенная к массе газа, Дж/кг·К
T – абсолютная температура газа. К
Умножая обе части уравнения (1) на молярную массу газа μ, получим уравнение состояния для 1 кмоля газа
Рνμ = μRT или РVμ = μRT (4)
где – Р- абсолютное давление, Па=Н/м2,
Vμ – объем 1 кмоля газа, м3/кмоль,
μ – молярная масса газа, кг/кмоль,
R –удельная газовая постоянная, отнесенная к массе газа, Дж/кг·К,
T – абсолютная температура газа, К.
μR- универсальная газовая постоянная, Дж/кмоль·К.
Выведем значение, размерность и физический смысл μR .
Из ур-ия (4) вычислим μR при нормальных физических условиях (Т0=273К, Р0=101332Па и
Vμ =22,4 м3/кмоль
μR
=
![]() (5)
(5)
Учитывая (5) перепишем (4)
РVμ = 8314T (6)
Это ур-ие носит название Клапейрона-Менделеева.
Универсальная газовая постоянная имеет одинаковое значение для 1кмоля любого газа, в том числе смеси и равна 8314Дж/кмоль·К.
[μR]=![]()
удельная газовая постоянна для данного газа и зависит от молярной массы газа.
![]() =
[R]=8314/μ=Дж·кмоль/кмоль·К·кг=Дж/кг·К.
=
[R]=8314/μ=Дж·кмоль/кмоль·К·кг=Дж/кг·К.
Смеси газов.
а)![]() - для 1 кмоля смеси газов.
(7)
- для 1 кмоля смеси газов.
(7)
![]()
![]()
![]() (8)
(8)
![]() (9)
;
(9)
;
![]()
![]() =
=![]() ;
(10)
;
(10)
![]() (11).
(11).
Параметры смеси вычисляются по правилу аддитивности.
![]() ,
(12)
,
(12)
где
R
R
R![]() -удельная
газовая постоянная компонентов смеси;
Дж/кг·К.
-удельная
газовая постоянная компонентов смеси;
Дж/кг·К.
![]() доля
компонентов смеси, безразмерная величина.
доля
компонентов смеси, безразмерная величина.
![]()
![]() (13)
(13)
где
![]() -молярная
масса компонента; кг/кмоль
-молярная
масса компонента; кг/кмоль
![]()
В термодинамике для газов мольные и объемные доли принимаются одинаковыми. Если параметр отнесен к массе, то берем Х, если к молям(объему)-У
б) для 1 кг смеси газов:
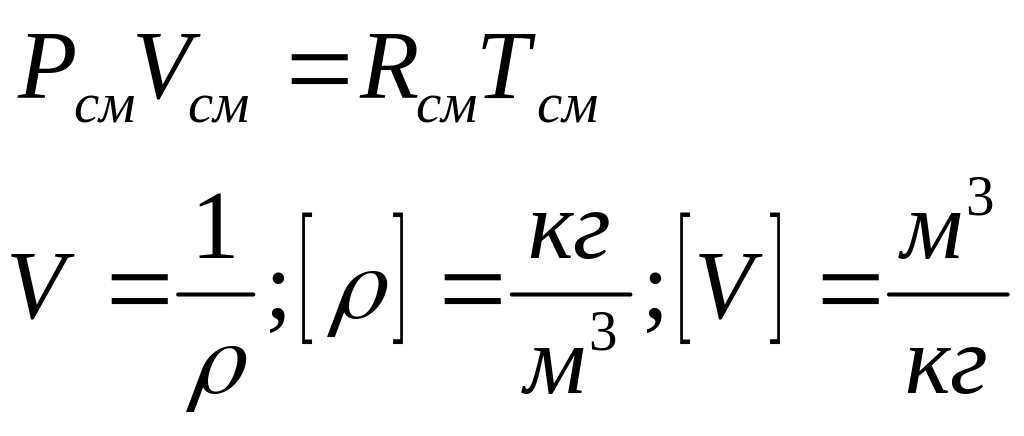 (14)
(14)
 (15).
(15).
в) для m кг смеси газов:

(16)
(17)
![]() (18)
(18)
yi- мольная доля компонента
хi- массовая доля компонента
i- молярная масса компонента
cм-молярная масса смеси.
Закон Дальтона -1) общее давление = сумме парциальных давлений.
![]() (19)
(19)
- 2) парциальное давление пропорционально давлению смеси и мольной (объемной) доле компонента.
![]() (20)
(20)
