- •Взаимодействие некоторых металлов с водными растворами щелочей
- •32 Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Сдвиг химического равновесия и принцип Ле Шателье
- •Нормальный водородный электрод
- •2. Метод молекулярных орбиталей молекулярных орбиталей методы
- •Виды коррозии по условиям протекания:
- •Виды коррозии по характеру разрушения:
- •Основные квантовые числа
- •Коррозия блуждающими токами Источники блуждающих токов
- •8.3 Защита металлов от коррозии
8.3 Защита металлов от коррозии
Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислородаиспользуют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие ипарофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
2) Защитные покрытия. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий дляэлектрохимической коррозии * разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент *:
А (–) Cr H2O, O2 Fe (+) К
на аноде: Cr – 2e → Cr2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Cr2+ + 2 OH– → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3

2
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 43
1. Металлические покрытия.
2. Основные положения теории электролитической диссоциации С.Аррениуса.
МЕТАЛЛОПОКРЫТИЯ
тонкие металлические или органические поверхностные покрытия металлических изделий, позволяющие улучшить их внешний вид, защитить от коррозии, повысить износостойкость, улучшить электрический контакт, облегчить пайку, изменить отражательные или поглощательные свойства в инфракрасном и видимом диапазонах спектра, а также нарастить размеры изделия. Серебро, золото, никель и хром наносятся на поверхность стали или других металлов как для улучшения внешнего вида, так и для защиты от коррозии. Кадмий и цинк используются для защиты от электрохимической коррозии; эти металлы защищают сталь за счет собственной коррозии, причем степень защиты практически пропорциональна толщине или массе покрытия. Другие металлы, используемые в качестве покрытий для стали, такие, как медь, никель, хром, олово, кобальт, серебро, золото и свинец, действуют как защитные пленки; степень защиты пропорциональна толщине лишь до тех пор, пока толщина обеспечивает непроницаемость покрытия. Толстые хромовые покрытия используются главным образом для увеличения износостойкости; кадмий и серебро применяются, когда надо обеспечить хороший электрический контакт; олово, медь, кадмий и никель - хорошие покрытия для пайки; родий, серебро и золото используются для увеличения отражательной способности поверхностей; черное оксидирование (воронение) применяется для увеличения поглощательной способности и собственного излучения поверхности; покрытия из никеля, хрома и железа позволяют наращивать размеры деталей. Для нанесения покрытий на поверхность металлических изделий обычно используются следующие методы: нанесение органических покрытий (краски, лаки, эмали), оксидирование, химическая обработка, диффузионная металлизация, погружение в расплав, металл, напыление и электролитическое осаждение. Органические покрытия. Масляные краски используются главным образом для наружной отделки или для защиты поверхности больших металлических конструкций; они сохнут настолько медленно, что не годятся для покрытия большинства металлических изделий. Этих недостатков лишены нитролаки, которые раньше широко применялись для покрытия металлических поверхностей, например автомобилей, из-за того, что они быстро сохнут, образуют прочную пленку, имеют высокую адгезию и низкую стоимость, однако сейчас они вытесняются синтетическими эмалями. Оксидирование. Существует несколько типов широко используемых процессов оксидирования. Алюминий применяется в качестве материала анода в растворе серной или хромовой кислоты. Образующийся при этом оксид обеспечивает хорошую защиту алюминия от коррозии, а также служит хорошей основой для нанесения органических покрытий. В некоторых случаях оксидная пленка может быть окрашена для получения необходимого цвета. Оксидные пленки на поверхности стали получают путем термической обработки, воздействием расплавленных окислителей (нитратов) и, чаще всего, погружением в щелочные растворы, нагретые до температуры 140-155° С. Медь и медные сплавы обрабатываются в щелочных растворах для получения пленки черной окиси меди. Красная закись образуется на меди при ее погружении в окислительный расплав. Серебро, медь и латунь "окисляют" с помощью растворов сульфидов для получения цветных и черных покрытий; эти покрытия представляют собой скорее сульфиды, чем оксиды. Химическая обработка поверхностей. Покрытия, получаемые методом химического полирования, служат для защиты от коррозии и как основа для нанесения органических покрытий. Для стали и цинка используется процесс фосфатирования с применением растворов, содержащих металлические фосфаты и деполяризаторы; цинк и кадмий обрабатываются в растворах хроматов для получения хромосодержащих покрытий, которые обладают высоким сопротивлением коррозии, вызываемой аэрозолями солей; магний также обрабатывается растворами хроматов для уменьшения коррозии и подготовки под окраску; буферные растворы молибдатов дают черное покрытие на цинке. Диффузионная металлизация. Некоторые металлы могут быть нанесены на поверхность изделий из других металлов простым химическим замещением из раствора. Медь из раствора медного купороса в серной кислоте может осаждаться на стали; еще лучшие результаты получаются при добавлении ингибитора для предотвращения воздействия серной кислоты на сталь. Ртуть может замещаться медью и латунью из растворов цианидов и образовывать гладкие с хорошей адгезионной способностью покрытия ртути, которые используются для подготовки латуни к серебрению. Погружение в расплав. Покрытия из олова и цинка наносятся путем погружения изделий в расплавленный металл. Горячие оловянные покрытия наносятся на стальную жесть (при производстве консервных банок), чугун, ковкий чугун, медь и медные сплавы, главным образом в изделиях, предназначенных для контакта с пищевыми продуктами, а также для электротехнического применения. Электролитическое осаждение. Правильная подготовка металлов к процессу электролитического осаждения, аналогично нанесению органических покрытий, требует удаления всех следов смазки, жира, частиц твердых загрязнений, окисной пленки и окалины для качественного нанесения покрытий. Латунирование. Покрытия из медно-цинковых сплавов могут быть получены из растворов цианидов; они позволяют получить соединения, напоминающие листовую латунь. Латунные покрытия стальных и других изделий часто используются для декоративных целей. Бронзирование. Настоящие бронзы, т.е. медно-оловянные сплавы могут быть получены из растворов цианидов. Содержание олова в бронзовых покрытиях составляет от 5 до 10%. Кадмирование. Кадмиевые покрытия защищают сталь от электрохимической коррозии и оказываются привлекательными в том отношении, что не образуют белых продуктов коррозии, как в случае цинковых покрытий. Детали с кадмиевым покрытием легко паяются и поэтому широко используются в электронной промышленности. Кадмий токсичен, и его не следует использовать в быту и на изделиях, которые будут контактировать с пищей. Хромирование. Существуют два типа таких покрытий: тонкое (декоративное) и толстое (технологическое). Декоративное покрытие - обычно блестящий хромовый слой толщиной от 0,0005 до 0,0025 мм. Декоративное покрытие толщиной от 0,00075 до 0,0015 мм наносится для защиты от коррозии никелевой подложки. Толстое покрытие в принципе не отличается от декоративного, однако его большая толщина (от 0,025 до 0,375 мм) повышает износостойкость изделия. Меднение. Медные покрытия, которые обеспечивают защиту от коррозии, получаются из растворов нескольких типов. Например, раствор медного купороса и серной кислоты используется для электрополирования или получения толстых покрытий. Растворы цианидов служат также для нанесения покрытий на стали, цинке, свинце и других металлах. Другие типы металлических покрытий. Другие металлы, осаждаемые из растворов цианидов, - золото, серебро и цинк. Железо осаждается из растворов хлорида железа, свинец - из растворов фторобората и фторосиликата, а олово - из щелочных растворов станнатов и фторобората. Покрытия из благородных металлов, таких, как родий, платина и палладий, также могут быть получены гальваническим путем.
2. Основные положения теории электролитической диссоциации С.Аррениуса.
Теория электролитической диссоциации |
||
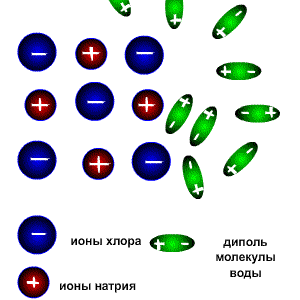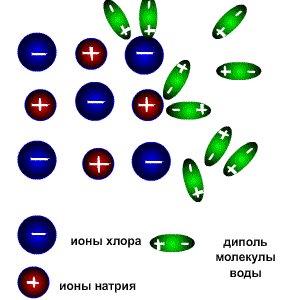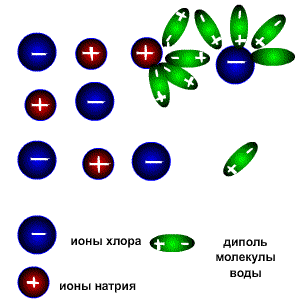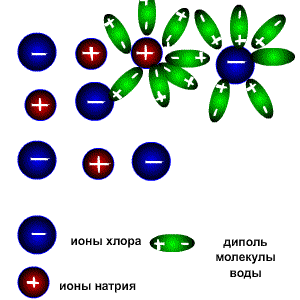
Растворы всех веществ можно разделить на две группы: электролиты-проводят электрический ток,неэлектролиты-проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты. Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2SO4 и т.д.) Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl). К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза. Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении. Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость. Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор. При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус .Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами. Схема электролитической диссоциации.
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности Уравнение диссоциации можно записать следующим образом:
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко. Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации. Сила электролитов. Силу электролитов можно охарактеризовать с помощью степени диссоциации. Степень диссоциации электролита-это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор.
Степень диссоциации потенциальных электролитов изменяется в пределах 0< α ≤1( значение α=0 относится к неэлектролитам). Степень диссоциации возрастает при увеличении разбавления раствора, а также при повышении температуры ( повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы.) Сила электролитов в водном растворе определяется их степенью диссоциации при постоянной концентрации и температуре. К сильным электролитам относятся относятся вещества степень диссоциации которых близка к 1. К ним относятся хорошо растворимые щёлочи, соли, кислоты. |
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 44
Протекторная и катодная защита металлов от коррозии.
2. Укажите, какие молекулы из перечисленных имеют угловую форму:
H2O, BeCl2, CO2, H2S?
Протекторная --способ антикоррозионной защиты, при котором защищаемой поверхности необходимо обеспечить контакт с более активным металлом (ссылка). По отношению к железу, более активными металлами являются кадмий, хром, цинк, магний и другие металлы.
Из механизма коррозии металла, следует, что более активный металл начинает испускать электроны и присоединять к образовавшимся ионам гидроксильной группы из раствора электролита, а другой, менее активный, будет принимать электроны, присоединяя их к своим ионам. В результате, более активный металл — анод — будет окисляться, а менее активный металл — катод восстанавливаться. Таким образом, анод будет защищать от коррозии
В результате, анод будет окисляться, а катодвосстанавливаться
Протекторная защита нашла широкое применение для защиты таких объектов как: подземные трубопроводы, резервуары, морские и речные суда и др. Все эти объекты находятся в постоянном контакте с электролитом, будь то грунтовые воды, химические растворы, морская или речная вода.
Для реализации протекторной защиты необходимо обеспечить соприкосновение самого протектора с чистой поверхностью защищаемого металла См. Рис. 1.
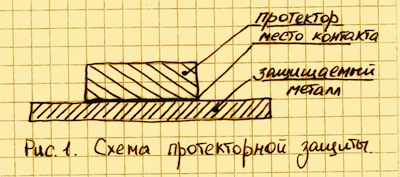
Если на эту конструкцию будет воздействовать внешняя среда, то электроны протектора будут переходить в защищаемый металл и на катоде начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами OH), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор. Таким образом, обеспечивается катодная защита металла до тех пор, пока протектор полностью не разрушится вследствие коррозии. После полного разрушения начнет корродировать и сам металл.
Среди лакокрасочных материалов выделят класс протекторных грунтовок (цинконаполненных или цинкосодержащих). Применение данного вида материалов получило название «холодное цинкование». Механизм их действия мы опишем в следующих постах.
Катодная Одним из способов антикоррозионной защиты является катодная защита металла.
Суть катодной защиты — полное прекращение самого процесса коррозии путем изменения потенциала (металла) металлоконструкции.
Катодная защита металла основана на том, что скорость коррозии пропорциональна активности металов, образующих гальваническую пару. В обычных условиях, металл является анодом и поэтому корродирует. Если изменить потенциал металлоконструкции относительно внешней среды, либо с помощью внутреннего источника напряжения, либо приведя в контакт с более активным металлом, то сама металлоконструкция станет катодом и корродировать не будет (либо скорость коррозии уменьшится в сотни раз), а разрушаться будет анод. В соответствии со способом изменения потенциала защищаемого металла различают: