
- •Взаимодействие некоторых металлов с водными растворами щелочей
- •32 Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
- •Электродные потенциалы активных и пассивных металлов
- •Величина равновесного электродного потенциала
- •Сдвиг химического равновесия и принцип Ле Шателье
- •Нормальный водородный электрод
- •2. Метод молекулярных орбиталей молекулярных орбиталей методы
- •Виды коррозии по условиям протекания:
- •Виды коррозии по характеру разрушения:
- •Основные квантовые числа
- •Коррозия блуждающими токами Источники блуждающих токов
- •8.3 Защита металлов от коррозии
31
1. Ионная связь. Механизм образования ионной связи. Свойства ионной связи. Достоинства и недостатки теории ионной связи.


Свойства: В отличие от ковалентной связи ионная связь не обладает насыщаемостью. Прочность ионных связей. Вещества с ионными связями в молекулах, как правило, имеют более высокие температуры кипения и плавления
Ионная связь не имеет определенной пространственной направленности, так как электрическое поле иона обладает сферической симметрией и одинаково убывает с расстоянием в любом направлении. Поэтому взаимодействие ионов не зависит от направления. Создаваемое ионами в окружающем пространстве электрическое поле тем сильнее, чем выше заряд иона и меньше его радиус.
Вследствие сферической симметрии электрического поля иона 2 разноименных иона, притянувшись друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. Именно поэтому данный ион может координировать вокруг себя еще некоторое число ионов противоположного знака.
2
Взаимодействие некоторых металлов с водными растворами щелочей
Щелочами металлы окисляться не могут, так как ионы щелочных металлов – одни из самых слабых окислителей в водных растворах. Однако в присутствии щелочей окисляющее действие воды может значительно возрастать. При окислении металлов водой образуется гидроксид и водород. Если характер оксида и гидроксида амфотерный, то они будут растворяться в щелочном растворе. В результате пассивные в чистой воде металлы могут энергично взаимодействовать с растворами щелочей.
Такое поведение характерно для следующей группы металлов:
Be, Al, Ga, Zn, Sn, Pb, Cr
На поверхности этих металлов присутствуют естественные оксидные пленки, нерастворимые в воде. При обычных условиях и даже при нагревании они защищают металл от контакта с ионами H+ и, следовательно, от возможности окисления.
Оксидные пленки этих металлов обладают амфотерными свойствами (способны реагировать как с кислотами, так и с щелочами) и химически растворяются щелочами:
Al2O3 + 2 NaOH → 2NaAlO2 + H2O
После растворения амфотерного оксида в щелочи металл реагирует с водой по схеме взаимодействия активного металла. При этом происходит образование амфотерного гидроксида:
2 Al + 6 H2O → 2 Al(OH)3↓ + 3 H2↑ (1)
Но на этом процесс не останавливается, далее следует взаимодействие амфотерного гидроксида со щелочью:
2 Al(OH)3 + 2 NaOH → 2 Na[Al(OH)4] (2)
Образуется гидроксокомплекс, в котором число гидроксильных групп OH- соответствует координационному числу (КЧ) иона металла. Для алюминия КЧ=4.
Суммарный процесс [(1)+(2)] взаимодействия алюминия с раствором щелочи можно выразить следующим уравнением:
2 Al + 6 H2O + 2 NaOH → 2 Na[Al(OH)4] + 3 H2
Таким образом, роль окислителя выполняют ионы водорода H+ из воды. Щелочь создает условия протекания этого процесса химически, растворяя сначала оксидную пленку, а затем и амфотерный гидроксид.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 32
1. Возникновение двойного электрического слоя на границе металл-раствор. Электродный потенциал.
2. Сдвиг химического равновесия. Принцип Ле-Шателье.
32 Гальванические элементы Возникновение двойного электрического слоя на границе металла и раствора
Общие свойства металлов:
электропроводность,
теплопроводность,
пластичность
- обусловлены типом химической связи в металлах, которая так и называется металлическая связь.
Суть металлической связи заключается в том, что часть атомов в металле теряет свои валентные электроны, превращаясь в ионы.
![]()
Таким образом, в узлах кристаллической решетки любого металла располагаются как нейтральные атомы, так и положительные ионы. Потерянные электроны располагаются в междоузлиях, образуя так называемый коллективный электронный газ, рис.1.
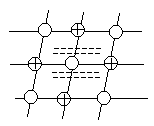
Рис.1
Ионы металла, располагающиеся на его границе, гидратируются молекулами воды:
![]() ,
рис.2.
,
рис.2.

Рис.2
Под влиянием всевозможных видов движения гидратированные ионы отрываются от металла и уходят в воду:
![]()
На границе металла и воды возникает двойной электрический слой, т.е. скачок потенциала Up,В, который называется равновесным электродным потенциалом.
Знак потенциала определяется по заряду металла. Количество ионов металла, содержащихся в литре насыщенного раствора, называется растворимостью металла.
По величине растворимости металлы подразделяются на:
активные,
пассивныe.
