
Билет 3.
1. В химии используются а относительные значение атомных масс. В 1961 г. за единицу атомной массы принята атомная единица массы (сокращенно а.е.м.), которая представляет собой ‘/12 часть массы атома изотопа углерода «С». Например, Ar(Н) =1,6747x 10-27 = 1,0079; 1/12 x 1,993 x 10-26 Относительная атомная масса — одна из основных характеристик химического элемента. Относительной молекулярной массой М, вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С. Вместо термина «относит атомная масса» можно использовать термин «атомная масса». Относ молекулярная масса численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Она легко подсчитывается по формуле вещества. Например Мг(H2O) слагается из 2Аr(Н)=2•1,00797=2,01594 Ar(0) =1x15, 9994 = 15,9994. Относит молекулярная масса показывает, во сколько масса молекулы данного вещества больше 1/12 массы атома С+12. Относит молекулярная масса—одна из основных характеристик вещества.
Моль. Молярная масса. За единицу количества вещества принят моль. Моль — это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов и других), сколько атомов содержится в 0,012 кг изотопа углерода С+12. Зная массу одного атома углерода (1,993 • 10-26 кг), можно вычислить число атомов NA в 0,012 кг углерода: NA=0,012 кг/моль = 1,993 х10-26 кг 6,02 х 1023 ед/моль. Это число называется постоянной Авогадро (обозначение НА размерность 1/моль), показывает число структурных единиц в моле любого вещества. Молярная масса — величина, равная отношению массы вещества к количеству вещества. Она имеет размерность кг/моль или г/моль; обычно ее обозначают буквой М. Молярную массу вещества легко вычислить, зная массу молекулы. Так, если масса молекулы воды равна 2,99х10-26, кг, то молярная масса Мr (Н2О) = 2,99 •10-26 кг • 6,02 • 1023 1/моль = 0,018 кг/моль, или 18 г/моль. В общем случае молярная масса вещества, выраженная в г/моль, численно равна относительной атомной или относительной молекулярной массе этого вещества. -Например, относительные атомные и молекулярные массы С, Fe, О, Н 2О соответственно равны 12, 56, 32,18, а их молярные массы составляют соответственно 12 г/моль, 56 г/моль, 32 г/моль, 18 г/моль. Молярная масса может быть подсчитана для веществ как в молекулярном, так и в атомном состоянии. Например, относительная молекулярная масса водорода Мr (Н 2) = 2, а относит атомная масса водорода А(Н) = 1. Количество вещества, определенное числом структурных единиц (НА), в обоих случаях одинаково — 1 моль. Однако молярная масса молекулярного водорода 2 г/моль, а молярная масса атомного водорода 1 г/моль. Один моль атомов, молекул или ионов содержит число этих частиц, равное постоянной Авогадро, например 1 моль атомов С+12 = 6,02 • 1023 атомов С+12 1 моль молекул Н2O = 6,02 • 1023 молекул Н2O 1 моль ионов S042- = 6,02 • 1023 ионов S042- Между массой вещества (т, г), количеством вещества (п, моль) и молярной массой (М, г/моль) существуют простые соотношения: m=NM, N=m/M M=m/N По этим формулам легко вычислить массу определенного количества вещества, или определить количество вещества в известной ассе его, или найти молярную массу вещества.
2.
Билет 4.
1.Стехиометрия: Закон сохранения массы вещества, постоянство состава. Закон эквивалентов. Относительная плотность газов.
1). Закон постоянства состава. Любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Закон постоянства состава не выполняется для бертоллидов (соединений переменного состава). Однако условно для простоты состав многих бертоллидов записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
Закон сохранения массы — закон физики, согласно которому масса физической системы сохраняется при всех природных и искусственных процессах. С точки зрения классической механики и химии, сохраняются общая масса закрытой физической системы, равная сумме масс компонентов этой системы (то есть масса считается аддитивной). Этот закон с большой точностью верен в области применимости ньютоновской механики и химии, так как релятивистские поправки в этих случаях пренебрежимо малы.
Относительная
плотность газа –
это сравнение молярной или относительной
молекулярной массы одного газа с
аналогичным показателем другого газа:
M1
D
= ——
M2 или
Mr1
D
= ——
Mr2 Обычно
плотность газов определяют по отношению
к водороду как самому легкому газу.
Часто газы сравнивают также с воздухом.

aA + bB = cC + dD,
где A, B – реагенты, C, D – продуты,
а,b,c,d – стехиометрические коэффициенты;
справедливо равенство:
n(1/z А) = n(1/z B) = n(1/z С) = n(1/z D) (8)
Это выражение (8) является математической записью закона эквивалентов.
Число моль эквивалентов вещества можно рассчитать через массу т(В) вещества В:
n(1/z B) = ![]() (9)
(9)
или объем V(B) газообразного вещества В:
n(1/z B) = ![]() (10)
(10)
Закон эквивалентов дает возможность производить расчеты без уравнения реакции. Кроме того, из закона эквивалентов можно вывести еще одну формулу для расчета молярной массы эквивалента оксида:
М(1/z оксида) = М(1/z элемента) + М(1/z О) = М(1/z элемента) + 8 (11)
2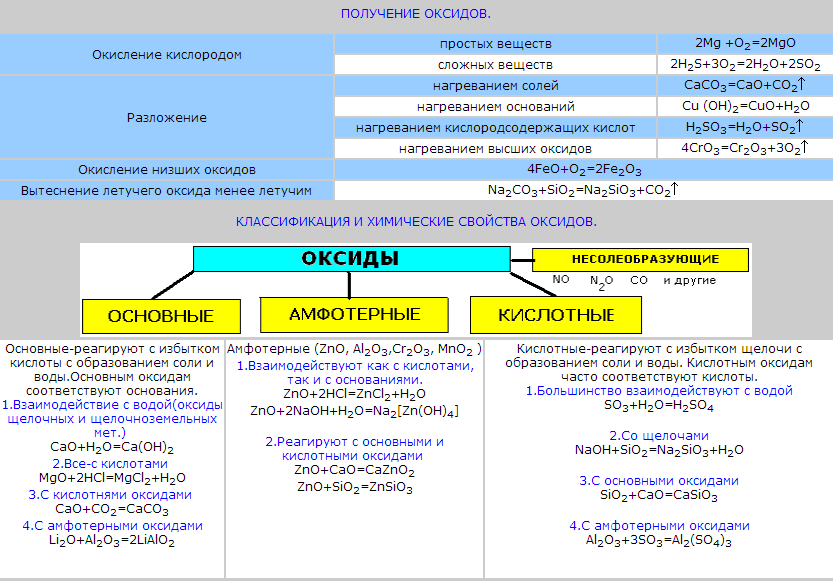 .)
Окси́д (о́кисел, о́кись) —
бинарное соединение химического
элемента с кислородом в
степени окисления −2, в котором сам
кислород связан только с
менееэлектроотрицательным элементом.
Химический элемент кислород
по электроотрицательности второй
после фтора,
поэтому к оксидам относятся почти все
соединения химических элементов с
кислородом. К исключениям относятся,
например, дифторид
кислорода OF2.
.)
Окси́д (о́кисел, о́кись) —
бинарное соединение химического
элемента с кислородом в
степени окисления −2, в котором сам
кислород связан только с
менееэлектроотрицательным элементом.
Химический элемент кислород
по электроотрицательности второй
после фтора,
поэтому к оксидам относятся почти все
соединения химических элементов с
кислородом. К исключениям относятся,
например, дифторид
кислорода OF2.
3)
Билет 5. 1) Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева. Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные) Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле
Степень окисления - это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.
Энергия ионизации всегда имеет эндоэнергетическое значение (это понятно, так как чтобы оторвать электрон от атома, требуется приложить энергию, самопроизвольно это произойти не может).
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;
мера проникающей способности этого электрона;
межэлектронное отталкивание среди наружных (валентных) электронов.
На энергию ионизации оказывают влияние также и менее значительные факторы, такие, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и др.
2) Хром — элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr . Простое вещество хром — твёрдый металл голубовато-белого цвета.
Химические свойства:
Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов.
При высокой температуре хром горит в кислороде, образуя оксид Сг2Оз.
to
4Сг + ЗО2 = 2Сг2О3
Металлический хром при нагревании реагирует с галогенами, галогено-водородами, серой, азотом, фосфором, углём, кремнием и бором.
Cr + 2HF = CrF2 + Н2
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
Cr + Si = CrSi
Для
соединений хрома характерны окислительно -
восстановительные реакции.
Соединения
хрома (II)
- сильные восстановители, они легкоокисляются
4(5гС12 +
О2 +
4HCI =
4СгС1з + 2Н2О
Для
соединений хрома (!!!) характерны
восстановительные свойства. Под
действием окислителей они переходят:
в
хроматы - в щелочной среде,
в
дихроматы - в кислой среде.
2Na3 [Сг(OH)6]
+ ЗВг2 +
4NaOH
= 2Na2CrO4 +
6NaBr
+ 8Н2О
5Cr2(SO4)3 +
6KMnO4 +
11H2O
= 3K2Cr2O7 +
2H2Cr2O7 +
6MnSO4 +
9H2SO4
Соли
хромовых кислот в кислой среде - сильные
окислители:
3Na2SO3 + К2Сг2О7 +
4H2SO4 =
3Na2SO4 + Cr2(SO4)3 +
K2SO4 +
4H2O
Применение:
Хром
является компонентом нержавеющих
сталей. Стали, содержащие хром, являются
жаропрочными и обладают высокой
стойкостью к коррозии.
К2Сг2О7 (хромпик), Na2Cr2O7 и
(NH4)2Cr2O7 применяют
для дубления кожи, в производстве
спичек, красок, взрывчатых веществ.

Раскалённый хром реагирует с парами воды:
2Сr + ЗН2О = Сг2О3 + ЗН2
* соли хрома (II), а если реакция протекает на воздухе - соли хрома (III).
Сг + 2HCI = СгСl2 + Н2
4Cr + 12HCI + О2 = 4СrCl3 + 4Н2 + 2Н2О
Оксиды и гидроксиды хрома:
Хром образует следующие оксиды и гидроксиды:
СrO Сг(ОН)2
Сг2O3 Сг(ОН)3
CrO3 Н2СrO4
Оксид хрома (II) СгО и соответствующий ему Сг(ОН)2, проявляют основные свойства:
СrO + 2HCI = CrCl2 + Н2O
Оксид хрома (II) превращается в оксид хрома (III).
Сr(ОН)2 получают в виде жёлтого осадка при действии раствора щёлочи на СrCl2
Сг2+ + 2ОН- = Сг(ОН)2
Сг(ОН)2 - восстановитель
При прокаливании превращается в Сг2О3
Соединения хрома (II) легко окисляются кислородом воздуха в соединения хрома (III).
2Сг(ОН)2 + 1/2О2 + Н2О = 2Сг(ОН)3
оксид хрома (III) Сг2О3 и гидроксид хрома (III) Сг(ОН)з - амфотерные соединения.
Сг2О3 - тугоплавкий порошок зеленого цвета. По твёрдости близок к корунду. Получается соединением элементов при
высокой температуре.
3 лаборатории получают нагреванием дихромата аммония:
t° (NН4)2Сг2O7 = Сг2О3 + N2 + 4Н2O
При растворении оксида и гидроксида (III) в растворах щелечей образуются комплексные соединения хрома:
Сг2О3 + 6NaOH + ЗН2О = 2Na3[(Cr(OH)6] при сплавлении - метахромиты
3)
