
- •Общие сведения о металлах. Классификация металлов.
- •Понятие о кристаллической решетке. Простейшие типы кристаллических решеток твердых тел.
- •Строение реальных кристаллов, дефекты кристаллического строения.
- •Понятие о механических, физических, химических и технологических свойствах металлов. Аллотропия и анизотропия свойств.
- •Плавление и кристаллизация металлов. Кристаллизация чистого металла. Условия образования мелкозернистой структуры.
- •Понятие: система, сплав, компонент, фаза, твердый раствор, химическое соединение.
- •Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком и твердом состояниях (ιι рода)
- •Связь между типами диаграммы состояния и свойствами по н.С. Курнакову
- •Железо, его совйства, полиморфные превращения чистого железа.
- •Влияние углерода и постоянных примесей на структуру и свойства сталей.
- •Классификация и маркировка углеродистых сталей. Области применения.
- •Конструкционные стали. Классификация и маркировка по качеству.
- •Классификация чугунов. Серый чугун, маркировка, свойства, область применения.
- •Ковкий и высокопрочный чугуны. Маркировка, свойства и назначение.
- •Цели легирования стали, основные легирующие элементы. Принцип маркировки легированных сталей.
- •Диаграмма изотермического превращения аустенита. Диффузионное превращение
- •Диаграмма изотермического превращения аустенита. Промежуточное превращение
- •Мартенситное превращение аустенита. Критическая скорость закалки.
- •Классификация видов термической обработки стали. Краткая характеристика
- •Отжиг стали. Виды и цели отжига. Нормализация.
- •Закалка стали. Полная и неполная закалка. Свойства закаленной стали.
- •Виды закалки в зависимости от способа охлаждения: закалка в 2-х охладителях, ступенчатая, изотермическая.
- •Прокаливаемость стали, дефекты закалки, их устранение и предупреждение.
- •Поверхностная закалка стали, её назначение.
- •Отпуск стали. Превращение при отпуске закаленной стали
- •Виды и цели отпуска стали. Структура отпущенной стали.
- •Хто, виды и цели хто.
- •Цементация стали, её виды, основные параметры и области применения.
- •Азотирование стали, сущность процесса, назначение.
- •Нитроцементация и цианирование, сущность процесса, назначение.
- •Диффузионная металлизация. Область применения.
- •Конструкционные стали: цементуемые, улучшаемые
- •Рессорно-пружинные стали. Термообработка.
- •Углеродистые инструментальны стали, назначение, маркировка.
- •39. Медь и ее сплавы. Латуни, маркировка и область применения
- •40. Бронзы, маркировка и область применения.
Связь между типами диаграммы состояния и свойствами по н.С. Курнакову
Между составом и структурой сплава, определяемой типом диаграммы состояния и свойствами сплава, имеется определенная зависимость (правило Н.С. Курнакова). В механических смесях свойства (твердость Н, электропроводность Е и др.) изменяются линейно. В твердых растворах свойства изменяются по криволинейной зависимости. В химических соединениях свойства выражаются ломаными линиями . При концентрации, соответствующей химическому соединению, отмечается характерный перелом на кривой свойств. Это объясняется тем, что химические соединения обладают индивидуальными свойствами, обычно резко отличающимися от свойств образующих их компонентов.
По диаграммам состояния можно определять и технологические свойства сплавов, что облегчает выбор материала для изготовления изделий. Так, твердые растворы имеют низкие литейные свойства (плохую жидкотекучесть, склонны к образованию пористости и трещин). В свою очередь эвтектические сплавы имеют хорошую жидкотекучесть
Железо, его совйства, полиморфные превращения чистого железа.
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al[2]). Считается также, что железо составляет бо́льшую часть земного ядра.
Свойства: Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддается прокатке, штамповке и волочению. Способность растворять углерод и других элементы служит основой для получения разнообразных железных сплавов. Железо может существовать в виде двух кристаллических решеток: α- и γ-объемноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910°С устойчиво α-Fe с ОЦК-решеткой (а = 2,86645Å при 20 °С). Между 910 °С и 1400°С устойчива γ-модификация с ГЦК-решеткой (а = 3,64Å). Выше 1400°С вновь образуется ОЦК-решетка δ-Fe (a = 2,94Å), устойчивая до температуры плавления (1539 °С). α-Fe ферромагнитно вплоть до 769 °С (точка Кюри). Модификации γ-Fe и δ-Fe парамагнитны.
Некоторые металлы (железо, титан, кобальт, цирконий и др.) при разных температурах имеют различные кристаллические решетки. Такое явление называется полиморфизмом или аллотропией. Процесс перехода из одного кристаллического строения в другое называется полиморфным (аллотропическим) превращением.
Строение, получающееся в результате полиморфного превращения, называется аллотропической формой. Аллотропическая форма, устойчивая при более низкой температуре, обозначается индексом a, при более высокой – b, g и т. д.
Температура, при которой происходит переход решетки из одного вида в другой, называется температурой полиморфного превращения или температурой перекристаллизации. При этом изменяются свойства металла (плотность, теплопроводность, теплоемкость и др.).
Аллотропические превращения при нагревании происходят с поглощением тепла, а при охлаждении – с его выделением. Как при нагревании, так и при охлаждении аллотропические превращения происходят с некоторым запаздыванием. Так, температура превращения a-модификации в b-модификацию, происходящего при нагревании, будет всегда выше температуры превращения b в a, происходящего при охлаждении. Такое явление называется гистерезисом.
До температуры 1539 °С происходит охлаждение жидкого железа. При 1539 °С на кривой охлаждения появляется площадка. При этой температуре железо затвердевает, и выделяется скрытая теплота кристаллизации. По окончании кристаллизации и до температуры 1392 °С железо имеет объемно-центрированную кубическую решетку (Fea ).При 1392 °С на кривой появляется вторая площадка, связанная с аллотропическим превращением a-железа (Fea) в g-железо (Feg), имеющее гранецентрированную кубическую решетку.При аллотропическом превращении исчезают старые зерна и появляются новые. Такое превращение аналогично процессу кристаллизации: вначале образуются зародыши, а затем идет рост зерен новой модификации. Такое превращение является перекристаллизацией. Следующая площадка наблюдается на кривой охлаждения при температуре 911 °С по причине превращения Feg в Fea. Кристаллическая решетка превращается из гранецентрированной опять в объемно-центрированную кубическую, которая сохраняется до самых низких температур.Площадка на кривой охлаждения, соответствующая температуре 768 °С, связана не с перестройкой кристаллической решетки, а с перестройкой электронных оболочек атомов и изменением магнитных свойств. Ниже 768 °С железо магнитно, а выше – немагнитно.Иногда немагнитное железо Fea называют Feβ, а высокотемпературную модификацию Fea (в интервале 1392…1539 °С) – Fed. Полиморфные превращения протекают как в чистых металлах, так и в сплавах.
Fe-Fe3C
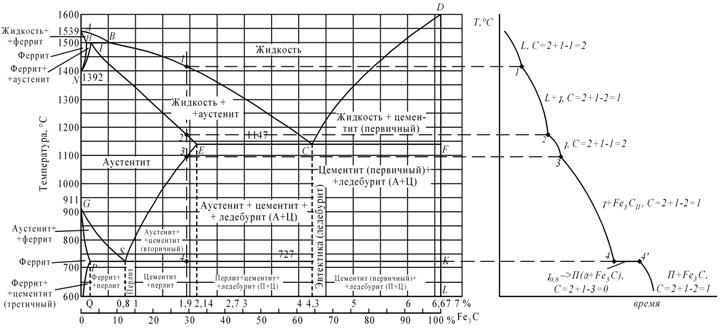
Первичная кристаллизация сплавов системы железо-углерод начинается по достижении температур, соответствующих линии ABCD (линии ликвидус), и заканчивается при температурах, образующих линию AHJECF (линию солидус).При кристаллизации сплавов по линии АВ из жидкого раствора выделяются кристаллы твердого раствора углерода в α-железе (δ-раствор). Процесс кристаллизации сплавов с содержанием углерода до 0,1 % заканчивается по линии АН с образованием α (δ)-твердого раствора. На линии HJB протекает перитектическое превращение, в результате которого образуется твердый раствор углерода в γ-железе, т. е. аустенит. Процесс первичной кристаллизации сталей заканчивается по линии AHJE.При температурах, соответствующих линии ВС, из жидкого раствора кристаллизуется аустенит. В сплавах, содержащих от 4,3 % до 6,67 % углерода, при температурах, соответствующих линии CD, начинают выделяться кристаллы цементита первичного. Цементит, кристаллизующийся из жидкой фазы, называется первичным. B точке С при температуре 1147°С и концентрации углерода в жидком растворе 4,3 % образуется эвтектика, которая называется ледебуритом. Эвтектическое превращение с образованием ледебурита можно записать формулой ЖР4,3Л[А2,14+Ц6,67]. Процесс первичной кристаллизации чугунов заканчивается по линии ECF образованием ледебурита.Таким образом, структура чугунов ниже 1147°С будет: доэвтектических – аустенит+ледебурит, эвтектических – ледебурит и заэвтектических – цементит (первичный)+ледебурит. Превращения, происходящие в твердом состоянии, называются вторичной кристаллизацией. Они связаны с переходом при охлаждении γ-железа в α-железо и распадом аустенита.Линия GS соответствует температурам начала превращения аустенита в феррит. Ниже линии GS сплавы состоят из феррита и аустенита.Линия ЕS показывает температуры начала выделения цементита из аустенита вследствие уменьшения растворимости углерода в аустените с понижением температуры. Цементит, выделяющийся из аустенита, называется вторичным цементитом. В точке S при температуре 727°С и концентрации углерода в аустените 0,8 % образуется эвтектоидная смесь состоящая из феррита и цементита, которая называется перлитом. Перлит получается в результате одновременного выпадения из аустенита частиц феррита и цементита. Процесс превращения аустенита в перлит можно записать формулой А0,8П[Ф0,03+Ц6,67].Линия PQ показывает на уменьшение растворимости углерода в феррите при охлаждении и выделении цементита, который называется третичным цементитом. Следовательно, сплавы, содержащие менее 0,008% углерода (точкаQ), являются однофазными и имеют структуру чистого феррита, а сплавы, содержащие углерод от 0,008 до 0,03% – структуру феррит+цементит третичный и называются техническим железом.Доэвтектоидные стали при температуре ниже 727ºС имеют структуру феррит+перлит и заэвтектоидные – перлит+цементит вторичный в виде сетки по границам зерен. В доэвтектических чугунах в интервале температур 1147–727ºС при охлаждении из аустенита выделяется цементит вторичный, вследствие уменьшения растворимости углерода(линия ES). По достижении температуры 727ºС (линия PSK) аустенит, обедненный углеродом до 0,8% (точка S), превращаясь в перлит. Таким образом, после окончательного охлаждения структура доэвтектических чугунов состоит из перлита, цементита вторичного и ледебурита превращенного (перлит+цементит).Структура эвтектических чугунов при температурах ниже 727ºС состоит из ледебурита превращенного. Заэвтектический чугун при температурах ниже 727ºС состоит из ледебурита превращенного и цементита первичного.
