
- •1.Термодинамика и ее метод исследования.
- •2.Параметры термодинамической системы. Температура.
- •3.Параметры термодинамической системы. Давление.
- •4.Параметры термодинамической системы. Удельный объем.
- •6.Внутренняя энергия системы.
- •7.Энтальпия.
- •8.Понятие термодинамического процесса и термодинамическое равновесие.
- •9.Работа. Свойства p-V диаграмм.
- •10.Теплота.Свойства t-s диаграмм.
- •11.Первый закон термодинамики для замкнутого пространства.
- •12.Второй закон термодинамики. Обратимые и необратимые процессы.
- •13.Идеальный газ. Уравнение Клапейрона-Менделеева.
- •14. Газовая постоянная. Универсальная газовая постоянная.
- •15.Реальные газы. Уравнение состояния реальных газов.
- •16.Смеси идеальных газов и их свойства. Определение состава смеси.
- •17.Закон Дальтoна. Парциальное давление.
- •18.Газовая постоянная и средняя молярная масса смеси.
- •19.Понятия и определения теплоемкости.
- •20.Теплоемкость смеси идеальных газов.
- •21.Изотермический процесс.
- •22.Изобарный процесс.
- •23.Изохорный процесс.
- •24.Адиабатный процесс.
- •25.Политpoпные процессы.
- •27. Уравнение неразрывности потока
- •28. Связь между параметрами и функциями состояния в адиабатном потоке
- •29. Сопло и диффузор. Комбинированное сопло Лаваля.
- •31.Понятие о тепловых машинах. Холодильные машины и тепловые двигатели
- •32. Цикл Карно и его кпд
- •33 Циклы двс с подводом теплоты при постоянном объеме
- •34 Циклы двс с подводом теплоты при постоянном давлении
- •35.Цикл двс со смешанным подводом теплоты
- •36 Сравнительный анализ циклов поршневых двс.
- •37. Тепловой поток. Температурное поле. Градиент температуры.
- •38. Основные процессы теплопереноса. Теплопроводность.
- •39. Основные процессы теплопереноса. Конвекция.
- •40. Основные процессы теплопереноса. Тепловое излучение.
- •41. Дифференциальные уравнения процесса теплообмена.
- •48. Теплопроводность при граничных условиях III рода. Многослойная плоская стенка
- •49 . Теплопроводность при граничных условиях III рода. Цилиндрическая стенка.
- •51.Критерии гидродинамического подобия, критерии Фруда, Эйлера, Рейнольдса.
- •53. Вынужденная конвекция. Число Рейнольдса. Режимы течения.
- •54. Свободная конвекция. Число Грасгофа.
- •55 . Критерий подобия поля температур и скоростей. Число Прандтля.
- •56 Определяющие и определяемый критерии.
- •58. Теплообмен при вынужденном движении жидкости вдоль плоской стенки
- •59.Теплообмен при вынужденном движении жидкости вдоль
- •60 Теплообмен при поперечном обтекании пучка труб
22.Изобарный процесс.
Изобарный процесс. Изобарный процесс —
процесс,
протекающий при постоянном давлении
газа ( ).
Изобара на диаграмме р
—
v
представлена
прямой, параллельной оси абсцисс. Из
уравнения состояний Клапейрона при
).
Изобара на диаграмме р
—
v
представлена
прямой, параллельной оси абсцисс. Из
уравнения состояний Клапейрона при
 следует
следует
 ,
для процесса 1— 2
,
для процесса 1— 2
 .
В
изобарном процессе объем газа
пропорционален термодинамической
температуре (закон Гей-Люссака). Уравнение
первого закона термодинамики
представим следующим образом:
.
В
изобарном процессе объем газа
пропорционален термодинамической
температуре (закон Гей-Люссака). Уравнение
первого закона термодинамики
представим следующим образом:
 .
.
Для
изобарного процесса последнее уравнение
перепишется так:
 для
процесса 1-2
для
процесса 1-2
 .
Теплота,
сообщаемая газу в изобарном процессе,
идет на увеличение его энтальпии.
Работа изменения объема в процессе 1-2
.
Теплота,
сообщаемая газу в изобарном процессе,
идет на увеличение его энтальпии.
Работа изменения объема в процессе 1-2
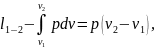 или учитывая, что
или учитывая, что
 ,
,
 ,
а
,
а
 ,
получим
,
получим
 .
При разности температур
.
При разности температур
 в
один кельвин газовая постоянная является
работой расширения, совершаемой в
изобарном процессе 1 кг газа. Количество
теплоты, полученной газом в изобарном
процессе
в
один кельвин газовая постоянная является
работой расширения, совершаемой в
изобарном процессе 1 кг газа. Количество
теплоты, полученной газом в изобарном
процессе
 .
Коэффициент 𝜁
для изобарного процесса определяется
по формуле
.
Коэффициент 𝜁
для изобарного процесса определяется
по формуле
 .
Илн,
если принять
.
Илн,
если принять
 ,
где k-показатель
адиабаты, 𝜁=1/k.
Например, при k=
1,4 (для воздуха) 𝜁=0,715.
Это означает, что 71,5% сообщаемой газу
теплоты идет на изменение его внутренней
энергии, а 28,5 %
расходуется
на совершение работы расширения.
Уравнение изобары в системе координат
Т
—
s
можно получить из зависимостей:
,
где k-показатель
адиабаты, 𝜁=1/k.
Например, при k=
1,4 (для воздуха) 𝜁=0,715.
Это означает, что 71,5% сообщаемой газу
теплоты идет на изменение его внутренней
энергии, а 28,5 %
расходуется
на совершение работы расширения.
Уравнение изобары в системе координат
Т
—
s
можно получить из зависимостей:
 ;
;
 откуда для процесса 1-2
получаем
откуда для процесса 1-2
получаем
 .
Изобара на диаграмме T-s
представлена логарифмической кривой.
Под касательная к изобаре на этой
диаграмме в любой точке в определенном
масштабе представляет собой истинную
изобарную теплоемкость ср.
Удельное количество теплоты
.
Изобара на диаграмме T-s
представлена логарифмической кривой.
Под касательная к изобаре на этой
диаграмме в любой точке в определенном
масштабе представляет собой истинную
изобарную теплоемкость ср.
Удельное количество теплоты
 ,
а так
как
,
оно равно изменению энтальпии газа
,
а так
как
,
оно равно изменению энтальпии газа
 .
Соотношения
.
Соотношения
 справедливы для всех процессов идеального
газа.
справедливы для всех процессов идеального
газа.
В процессе 1-2 теплота подводится, газ расширяется, увеличиваются температура и энтропия газа, в процессе 1—2' теплота отводится, газ сжимается, температура и энтропия уменьшаются.
Подставим
в уравнения первого закона термодинамики
соотношение, характерное для изобарного
процесса pdv=RdT.
Разделив полученное выражение на
dТ,
получаем
 ,
откуда
,
откуда
 Это
уравнение Р. Майера. Из него видно, что
удельная изобарная теплоемкость
всегда больше удельной изохорной на
газовую постоянную.
Это
уравнение Р. Майера. Из него видно, что
удельная изобарная теплоемкость
всегда больше удельной изохорной на
газовую постоянную.
23.Изохорный процесс.
Изохорный
процесс.
Изохорный
процесс - процесс. происходящий при
постоянном объеме газа:
 .
В соответствии с данным уравнением
изохорный процесс изображается на
диаграмме р-v
вертикальной
прямой. Эта линия называется изохорой
(линия 1–2
- теплота
подводится, давление возрастает; линия
1-2' - теплота отводится, давление
уменьшается). Из уравнения состояния
идеального газа для изохорного процесса
.
В соответствии с данным уравнением
изохорный процесс изображается на
диаграмме р-v
вертикальной
прямой. Эта линия называется изохорой
(линия 1–2
- теплота
подводится, давление возрастает; линия
1-2' - теплота отводится, давление
уменьшается). Из уравнения состояния
идеального газа для изохорного процесса
 ,
или для процесса 1-2
,
или для процесса 1-2
 .
В изохорном процессе давление газа
пропорционально термодинамической
температуре. Это соотношение представляет
собой закон Шарля. Запишем уравнение
первого закона термодинамики в виде
.
В изохорном процессе давление газа
пропорционально термодинамической
температуре. Это соотношение представляет
собой закон Шарля. Запишем уравнение
первого закона термодинамики в виде
 .
Для изохорного процесса работа изменения
объема не совершается, так как dl=pdv=0.
Поэтому последнее уравнение принимает
вид dq=du,
или для процесса 1-2
.
Для изохорного процесса работа изменения
объема не совершается, так как dl=pdv=0.
Поэтому последнее уравнение принимает
вид dq=du,
или для процесса 1-2
 .
Теплота,
сообщаемая газу или отведенная от
него в изохорном процессе, идет на
изменение внутренней энергии (𝜁=1).
При подведении теплоты внутренняя
энергия газа увеличивается, при отведении
- уменьшается. Элементарное
количество теплоты при изохорном
процессе
.
Теплота,
сообщаемая газу или отведенная от
него в изохорном процессе, идет на
изменение внутренней энергии (𝜁=1).
При подведении теплоты внутренняя
энергия газа увеличивается, при отведении
- уменьшается. Элементарное
количество теплоты при изохорном
процессе
 или
,
откуда, приравнивая правые части
уравнений, определяем изменение энтропии
или
,
откуда, приравнивая правые части
уравнений, определяем изменение энтропии
 ,
или для процесса 1-2:
,
или для процесса 1-2:
 .
График изохорного процесса на диаграмме
Т
-
s
представляет логарифмическую кривую
(кривая 1-2 - тепло подводится, энтропия
и температура возрастают; кривая
1-2'—тепло
отводится, энтропия и температура
уменьшаются). Количество теплоты,
сообщаемое газу или отводимое от него
в процессе 1-2
(2'),
.
График изохорного процесса на диаграмме
Т
-
s
представляет логарифмическую кривую
(кривая 1-2 - тепло подводится, энтропия
и температура возрастают; кривая
1-2'—тепло
отводится, энтропия и температура
уменьшаются). Количество теплоты,
сообщаемое газу или отводимое от него
в процессе 1-2
(2'),
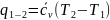 ;
.
;
.
Внутренняя энергия идеального газа во всех процессах, протекающих в одном и том же интервале температур, изменяется на одну и ту же величину независимо от характера процесса. Вследствие этого выражение ; справедливо для всех процессов идеального газа.
На
диаграмме Т-s
подкасательная
к кривой процесса в любой ее точке
определяет истинное значение удельной
изохорной теплоемкости
 .
Причем чем больше теплоемкость
,
тем
более полого проходит кривая процесса.
Полезная внешняя работа
.
Причем чем больше теплоемкость
,
тем
более полого проходит кривая процесса.
Полезная внешняя работа
 .
Изменение энтальпии в изохорном процессе
определяем из уравнения
.
Изменение энтальпии в изохорном процессе
определяем из уравнения
 .
Дифференцируем это выражение:
.
Дифференцируем это выражение:
 получаем
(pdv=0)
получаем
(pdv=0)
 ,
для процесса 1-2
,
для процесса 1-2
 ,
или
,
или
 .
.
