
- •1.Термодинамика и ее метод исследования.
- •2.Параметры термодинамической системы. Температура.
- •3.Параметры термодинамической системы. Давление.
- •4.Параметры термодинамической системы. Удельный объем.
- •6.Внутренняя энергия системы.
- •7.Энтальпия.
- •8.Понятие термодинамического процесса и термодинамическое равновесие.
- •9.Работа. Свойства p-V диаграмм.
- •10.Теплота.Свойства t-s диаграмм.
- •11.Первый закон термодинамики для замкнутого пространства.
- •12.Второй закон термодинамики. Обратимые и необратимые процессы.
- •13.Идеальный газ. Уравнение Клапейрона-Менделеева.
- •14. Газовая постоянная. Универсальная газовая постоянная.
- •15.Реальные газы. Уравнение состояния реальных газов.
- •16.Смеси идеальных газов и их свойства. Определение состава смеси.
- •17.Закон Дальтoна. Парциальное давление.
- •18.Газовая постоянная и средняя молярная масса смеси.
- •19.Понятия и определения теплоемкости.
- •20.Теплоемкость смеси идеальных газов.
- •21.Изотермический процесс.
- •22.Изобарный процесс.
- •23.Изохорный процесс.
- •24.Адиабатный процесс.
- •25.Политpoпные процессы.
- •27. Уравнение неразрывности потока
- •28. Связь между параметрами и функциями состояния в адиабатном потоке
- •29. Сопло и диффузор. Комбинированное сопло Лаваля.
- •31.Понятие о тепловых машинах. Холодильные машины и тепловые двигатели
- •32. Цикл Карно и его кпд
- •33 Циклы двс с подводом теплоты при постоянном объеме
- •34 Циклы двс с подводом теплоты при постоянном давлении
- •35.Цикл двс со смешанным подводом теплоты
- •36 Сравнительный анализ циклов поршневых двс.
- •37. Тепловой поток. Температурное поле. Градиент температуры.
- •38. Основные процессы теплопереноса. Теплопроводность.
- •39. Основные процессы теплопереноса. Конвекция.
- •40. Основные процессы теплопереноса. Тепловое излучение.
- •41. Дифференциальные уравнения процесса теплообмена.
- •48. Теплопроводность при граничных условиях III рода. Многослойная плоская стенка
- •49 . Теплопроводность при граничных условиях III рода. Цилиндрическая стенка.
- •51.Критерии гидродинамического подобия, критерии Фруда, Эйлера, Рейнольдса.
- •53. Вынужденная конвекция. Число Рейнольдса. Режимы течения.
- •54. Свободная конвекция. Число Грасгофа.
- •55 . Критерий подобия поля температур и скоростей. Число Прандтля.
- •56 Определяющие и определяемый критерии.
- •58. Теплообмен при вынужденном движении жидкости вдоль плоской стенки
- •59.Теплообмен при вынужденном движении жидкости вдоль
- •60 Теплообмен при поперечном обтекании пучка труб
6.Внутренняя энергия системы.
Внутренняя энергия. Существует общая количественная мера движения, которая для совокупности всех взаимодействующих тел остается неизменной.
Единая количественная мера различных форм движения материи называется энергией.
Материальные объекты, выделенные в качестве термодинамической системы, характеризуются запасом энергии, которая представляет собой внутреннюю энергию системы [обозначается U, единица — джоуль (Дж)]. Величина, определяемая отношением внутренней энергии системы к ее массе, называется удельной внутренней энергией и (Дж/кг).
В
термодинамических расчетах обычно
определяется не внутренняя энергия
системы как таковая, а ее изменение,
соответствующее изменению состояния
системы при ее взаимодействии с
окружающей средой. Внутренняя энергия
является однозначной функцией
состояния, и ее изменение определяется
только начальным и конечным состояниями
системы (не зависит от промежуточных
состояний, т. е. пути перехода системы)
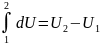 .
Величина dU
представляет
собой полный дифференциал. Как функция
состояния внутренняя энергия может
быть выражена через параметры состояния.
В частном случае для термомеханической
системы, например U=U(S,V).
.
Величина dU
представляет
собой полный дифференциал. Как функция
состояния внутренняя энергия может
быть выражена через параметры состояния.
В частном случае для термомеханической
системы, например U=U(S,V).
Внутренняя энергия слагается из кинетической энергии поступательного и вращательного движения молекул и колебательного движения атомов, ядерной энергии и др.
При изучении состояния идеального газа принимается, что внутренняя энергия слагается из кинетической энергии поступательного и вращательного движения молекул и энергии колебательного движения атомов молекул. Для реальных газов возникает необходимость учитывать энергию, связанную с наличием сил взаимодействия между молекулами.
7.Энтальпия.
Энтальпия. В термодинамических расчетах применяется и другая функция состояния, называемая энтальпией (обозначается Н, единица энтальпии -Дж).
Энтальпия — функция состояния термодинамической системы, равная сумме внутренней энергии и произведения давления на объем системы: Н=U+pV.
Удельная энтальпия (Дж/кг): h=u+pv
Физический смысл энтальпии раскрывается при анализе состояния движущегося газа. Энтальпия, как и другие функции состояния (внутренняя энергия, энтропия), определяется расчетным путем.
8.Понятие термодинамического процесса и термодинамическое равновесие.
Термодинамический
процесс
-- совокупность непрерывно изменяющихся
состояний термодинамической системы.
Причиной возникновения термодинамических
процессов является взаимодействие
системы и окружающей среды. Признаком
процесса является изменение хотя бы
одного из термодинамических параметров
состояния системы. Для возникновения
процессов в системе, находящейся в
состоянии термодинамического
равновесия, необходимы внешние
воздействия. Интенсивность
взаимодействия определяется движущей
силой процесса, которая равна разности
внешних и внутренних потенциалов
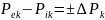
Термодинамическое равновесие. Взаимодействие системы и среды возможно только при наличии разности соответствующих потенциалов. Отсюда следует, что при равенстве внешних и внутренних потенциалов система не взаимодействует с окружающей средой, не происходит обмена энергией и веществом с другими телами, т. е. система находится в состоянии термодинамического равновесия. Самопроизвольный выход из этого состояния (без внешних воздействий) для системы невозможен.
Условие
равновесия может быть представлено
равенством
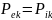 .
.
Термодинамическое равновесие, по существу, является равновесием макрофизическим. Микрофизические процессы (движение молекул, атомов, взаимодействие элементарных частиц) не прекращаются в системах, находящихся в равновесном состоянии. Микро движение не зависит от макроскопического состояния системы и, более того, обусловливает состояние термодинамического равновесия. Например, постоянная температура газа обусловливается постоянством
средней кинетической энергий движения молекул газа и т. д.
