
- •83. Термодинаміка біологічних систем (основні визначення термодинаміки, термодинамічні системи).
- •1.Термодинаміка, як наука
- •2. Термодинамічні системи
- •84. Термодинаміка відкритих систем. Основні положення нерівноважної термодинаміки.
- •1.Стаціонарний стан
- •2. Термодинаміка незворотніх процесів
- •3. Основні положення лінійної нерівноважної термодинаміки
- •85. Термодинамічна ймовірність. Рівняння Больцмана
- •86. Термодинамічні потенціали.
- •87. Термодинамічні функції
- •88. Типи фазових портретів
- •89. Ферментативний каталіз
87. Термодинамічні функції
88. Типи фазових портретів
89. Ферментативний каталіз
Кількісною характеристикою, за якою описуються кінетичні процеси, є швидкість реакції ν.
Н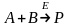 ехай
розглянемо просту хімічну реакцію
синтезу:
ехай
розглянемо просту хімічну реакцію
синтезу:
Ш

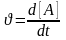 видкість
реакції ν є зміною в часі концентрації
речовин:
видкість
реакції ν є зміною в часі концентрації
речовин:
К інетичне
рівняння для цієї реакції можна записати
таким чином:
інетичне
рівняння для цієї реакції можна записати
таким чином:
Ф ерментативні
реакції, що йдуть з надлишком субстрату
належать до нульового
порядку.
ерментативні
реакції, що йдуть з надлишком субстрату
належать до нульового
порядку.
Створення першої теорії ферментативної реакція (Л. Міхаеліс, М. Ментен, 1913).
У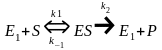 цій теорії постулювалося утворення
короткоживучого фермент-субстратного
комплексу ES у простій реакції:
цій теорії постулювалося утворення
короткоживучого фермент-субстратного
комплексу ES у простій реакції:
де Е1 – вільний фермент; Р – продукт реакції; ES – фермент-субстратний комплекс.
З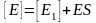 агальна
концентрація ферменту становитиме:
агальна
концентрація ферменту становитиме:
К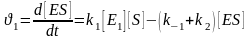 інетичне
рівняння швидкості утворення та розпаду
фермент-субстратного комплексу ES можна
записати таким чином:
інетичне
рівняння швидкості утворення та розпаду
фермент-субстратного комплексу ES можна
записати таким чином:
В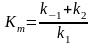 ідношення
констант швидкості називається константою
Міхаеліса
ідношення
констант швидкості називається константою
Міхаеліса
П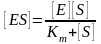 ісля
запуску ферментативної реакції з часом
настає стаціонарний стан, коли ν1=0. За
умови стаціонарності можна встановити
значення швидкості реакції, отже
концентрація фермент-субстратного
комплексу ES буде дорівнювати:
ісля
запуску ферментативної реакції з часом
настає стаціонарний стан, коли ν1=0. За
умови стаціонарності можна встановити
значення швидкості реакції, отже
концентрація фермент-субстратного
комплексу ES буде дорівнювати:
Дане рівняння називають рівнянням Міхаеліса-Ментен
С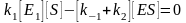 хематично
взаємодію фермент-субстраного комплексу
можна зообразити наступним чином.
хематично
взаємодію фермент-субстраного комплексу
можна зообразити наступним чином.
Інгібування
Речовини, які зменшують швидкість ферментативної реакції, називають інгібіторами.
Найпоширенішим типом інгібування є конкурентне інгібування. У цьому випадку інгібітор зв'язується з тим самим активним центром ферменту, що й субстрат, утворюючи неактивний комплекс ЕІ.
К
 онцентрацію
загального ферменту можна записати
таким чином:
онцентрацію
загального ферменту можна записати
таким чином:
Н еконкурентний
інгібітор
зв'язується не з активним центром, а в
іншому місці, й утворюється неактивний
комплекс ESI, і швидкість реакціях
визначається таким чином:
еконкурентний
інгібітор
зв'язується не з активним центром, а в
іншому місці, й утворюється неактивний
комплекс ESI, і швидкість реакціях
визначається таким чином:
Механізм взаємодії:
Статична модель Фішера – пояснює жорстку підгонку субстрату до активного центру ферменту (ключ - замок)
Індукована модель Кошланда – пояснює суттєві конформаційні зміни субстрату, коли він проникає в активний центр ферменту, тобто через конформаційну перебудову останнього відбувається точна орієнтація каталітичних груп ферменту для перетворення субстрату (рука-рукавичка)
