
- •83. Термодинаміка біологічних систем (основні визначення термодинаміки, термодинамічні системи).
- •1.Термодинаміка, як наука
- •2. Термодинамічні системи
- •84. Термодинаміка відкритих систем. Основні положення нерівноважної термодинаміки.
- •1.Стаціонарний стан
- •2. Термодинаміка незворотніх процесів
- •3. Основні положення лінійної нерівноважної термодинаміки
- •85. Термодинамічна ймовірність. Рівняння Больцмана
- •86. Термодинамічні потенціали.
- •87. Термодинамічні функції
- •88. Типи фазових портретів
- •89. Ферментативний каталіз
83. Термодинаміка біологічних систем (основні визначення термодинаміки, термодинамічні системи).
1.Термодинаміка, як наука
Термодинаміка – наука, котра вивчає загальні закономірності перетворення різних видів енергії у системі.
Вона дає макроскопічний опис енергетичних змін і перетворень, не розглядаючи молекулярної будови системи. Закони термодинаміки були виведені на основі життєвого досвіду, мають універсальний характер і виконуються як у живій, так і неживій матерії.
2. Термодинамічні системи
Термодинамічна система – частина простору з матеріальним вмістом, оточена оболонкою; ділянка поза оболонкою це зовнішнє середовище.
У залежності від того, як термодинамічна система зв'язана з зовнішнім середовищем розрізняють три типи систем:
Ізольована – не обмінюється ні речовиною, ні енергією;
Замкнута (закрита) - обмінюється енергією, однак обміну речовини в ній немає;
Відкрита – відбувається обмін із зовнішнім середовищем і речовиною, і енергією.
Термодинамічна система характеризується певними термодинамічними величинами :
екстенсивні параметри залежать від загальної кількості речовини у системі (наприклад, маса m, об'єм V);
інтенсивні параметри навпаки не залежать від кількості речовини у системі (наприклад, тиск p, температура T, молярна концентрація n);
Зміни будь-якого з цих параметрів викликають зміни стану системи. Розрізняють :
Зворотні зміни – якщо в циклічному процесі стан системи не змінюється;
Незворотні зміни (усі реальні процеси належать до незворотніх процесів)
Класична термодинаміка визначає різниці енергій та напрям можливих змін. Використання класичної термодинаміки має великі обмеження оскільки вона описує рівноважні стани й нічого не говорить про кінетику процесів.
Основні завдання термодинаміки полягає в тому, щоб найти такі величини, які б однозначно визначали зміну стану термодинамічної системи, при переході із одного стану в інший.
Термодинаміка базується на основних принципах – законах термодинаміки.
84. Термодинаміка відкритих систем. Основні положення нерівноважної термодинаміки.
1.Стаціонарний стан
Класична термодинаміка, розроблена для закритих та ізольованих термодинамічних систем, розглядає рівноважні стани в них.
Тоді як у відкритих системах постійно відбувається обмін із зовнішнім середовищем енергією та речовиною й замість термодинамічної рівноваги встановлюється стаціонарний стан.
Подібність рівноваги та стаціонарний стану полягає в тому, що більшість параметрів системи не змінюється за часом.
ПРИНЦИПОВІ ВІДМІННОСТІ:
за рівноваги не відбувається зміни вільної енергії (ΔG=0, ΔF=0), а ентропія прагне до максимального значення (S → max).
у стаціонарному стані зміна вільної енергії підтримується на постійному рівні (ΔG=const, ΔF=const), а величина ентропії відрізняється від максимального значення.
2. Термодинаміка незворотніх процесів
У відкритих системах відбуваються необоротні процеси, які проходять за межами стану рівноваги, тобто маємо справу з реальними незворотними процесами. Такі процеси описує термодинаміка незворотних процесів.
Основи лінійної нерівноважної термодинаміки закладено Ларсом Онзагером і далі розвинув російський вчений Ілля Пригожин.
Зміна ентропії у відкритій системі
З агальна
ентропія у відкритій системі, яка
обмінюється із зовнішнім середовищем
енергією та речовиною, становитиме:
агальна
ентропія у відкритій системі, яка
обмінюється із зовнішнім середовищем
енергією та речовиною, становитиме:
Внесок у продукцію ентропії роблять тільки незворотні процеси – теплопровідність, дифузія, хімічні реакції, тощо.
З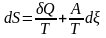 агальна
зміна ентропії у відкритій системі з
урахуванням обміну енергією із зовнішнім
середовищем і хімічним перетворенням
в самій системі становитиме:
агальна
зміна ентропії у відкритій системі з
урахуванням обміну енергією із зовнішнім
середовищем і хімічним перетворенням
в самій системі становитиме:
О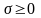 тже,
ІІ закон термодинаміки для відкритих
систем:
тже,
ІІ закон термодинаміки для відкритих
систем:
Швидкість продукції ентропії
Значними досягненнями термодинаміки незворотніх процесів на відміну від рівноважної термодинаміки, стало вивчення термодинамічних функцій у часі.
Ш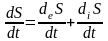 видкість
продукції ентропії – зміна в часі
ентропії. Загальна швидкість продукції
ентропії дорівнює сумі потоку ентропії
через відкриту систему і швидкості
продукції ентропії в самій системі
завдяки незворотнім процесам:
видкість
продукції ентропії – зміна в часі
ентропії. Загальна швидкість продукції
ентропії дорівнює сумі потоку ентропії
через відкриту систему і швидкості
продукції ентропії в самій системі
завдяки незворотнім процесам:
Дисипативна функція
При розгляді незворотного процесу в макроскопічній системі можна виділити два типи величин, що характеризують цей процес. Наприклад:
Теплопровідність=потік тепла+градієнт потенціалу.
Електропровідність=сила струму+градієнт потенціалу
Таким чином, у найбільш загальній феноменологічній формі будь-який процес характеризується добутком узагальненої сили Х (причина) на узагальнений потік J (швидкість процесу). Залежно від природу процесу узагальнена сила може бути різною:
у хімічних реакціях – це спорідненість хімічної реакції А,
в механічних процесах – механічна сила F,
в електричних явищах – різниця потенціалів Δφ,
для дифузії – градієнт концентрації,
для теплопровідності – градієнт теплоти.
