
- •2. Існують три основні аспекти геохімічних досліджень:
- •3. Прикладні аспекти геохімічних досліджень:
- •7. Основні джерела інформації про склад Всесвіту. Космічна розповсюдженість елементів.
- •8. Будова ядер атомів як чинник що визначає поширеність елементів та їх ізотопів
- •9. Походження та поширеність елементів в Сонячній системі.
- •10. Геохімія планет земної групи (Меркурій, Венера,Земля, Марс).
- •11. Метеорити, їх склад та класифікація.
- •12.Геохімія Місяця. Значення досліджень складу місячних порід для вирішення питань походження Землі.
- •13. Значення вивчення складу метеоритів для дослідження глибинних геосфер Землі.
- •14. Сучасні уявлення щодо походження і складу Землі
- •16. Розповсюдженість хімічних елементів в мантії та ядрі Землі. Моделі складу ядра.
- •17. Розповсюдженість хімічних елементів в земній корі.
- •18. Розсіяний та концентрований стан хімічних елементів в природі.
- •Поняття про кларки та методи їх оцінки. Коефіцієнти розсіяння та концентрації. Основний геохімічний закон Ферсмана- Гольшмідта.
- •26. Фактори, що контролюють міграцію та розподіл елементів в геосферах, взаємозв*язок між ними.
- •27. Основні методологічні засади геохімії радіогенних ізотопів.
- •28. Застосування радіоактивних ізотопів при вирішенні питань петрогенезису магматичних порід
- •29. Застосування радіогенних ізотопів при дослідженні водних систем та осадових утворень
- •30. Використання радіогенних ізотопів при визначенні віку порід
- •31. Радіоактивний розпад, як фактор, що контролює розподіл елементів.
- •32. Основні методологічні засади геохімії стабільних ізотопів
- •33. Залежність розподілу ізотопів від температури. Ізотопні геотермометри
- •35. Розподіл ізотопів в біологічних системах
- •36. Використання ізотопів кисню та водню при вирішенні питань петрогенезису порід.
- •37. Чинники що контролюють розподіл ізотопів сірки в геохімічних системах.
- •38. Інформативність вивчення розподілу ізотопів сірки при вирішенні питань петрогенезису гідротермальних систем.
- •39. Структура силікатного розплаву. Основні засади теорії полімерів.
- •41. Структурний контроль розподілу елементів в твердих тілах.
- •42. Використання закону діючих мас в геохімії.
- •43. Фугітивність і активність, їх значення для геохімії.
- •46. Побудова діаграм стійкості мінералів як функції парціального тиску газів.
- •Стійкість води
- •47. Побудова діаграм стійкості мінералів в координатах Eh-pH
- •55. Гідротермальні геохімічні системи
- •56. Метаморфогенні геохімічні бар'єри
- •57.Геохімічна характеристика пегматитів.
- •58. Геохімія ультраосновних магматичних порід
- •59. Геохімія основних магматичних порід
- •60. Геохімія гранітоїдів
- •61. Металогенічна спеціалізація магматичних порід.
- •62. Геохімія магматичних порід лужного ряду
- •65. Геохімічна роль живої речовини.
- •66. Геохімія атмосфери
- •67. Геохімія гідросфери
- •68. Геохімічні особливості магматогенних систем
- •69. Геохімія біосфери
46. Побудова діаграм стійкості мінералів як функції парціального тиску газів.
Рівноважні співвідношення між мінералами при 25°C і 1 атм загального тиску зумовлюються реакціями першого типу, тобто реакціями з участю тільки твердих речовин. Графічно зобразити ці співвідношення неможливо, оскільки вони залежать тільки від температури і тиску. Лише в рідкісних випадках вільна енергія такої реакції при подібних довільно вибраних умовах рівна нулю. Однак реакцію другого типу - з участю газової фази будь-якої активності - можна представити графічно у вигляді функції активності даної газової фази. В умовах, що нас цікавлять, тобто низьких температур і тиску активність газової фази безпосередньо визначається величиною її парціального тиску. Практично це справедливе для всіх газів, бо вони в таких умовах близькі до ідеальних.
Якщо в реакції бере участь газова фаза, то в стандартних умовах рівновага завжди може бути досягнута шляхом зміни парціального тиску відповідного газу.
За допомогою діаграм парціальних тисків зручно також розглядати взаємовідношення між сульфідами і окислами металів. Для характеристики подібних співвідношень ми використаємо двоатомну газоподібну сірку. Молекулярні частки газоподібної сірки при 25°C навряд чи є стійкими; більш ймовірно, що в таких умовах сірка перебуває у вигляді часток з більшим числом атомів, ніж у S2. Однак для нашої мети вибір газових часток не має істотного значення, оскільки вони використовуються тільки як критерій, що дозволяє порівнювати реакції мінералів заліза з реакціями між іншими мінералами. Крім того, визначивши стійкі співвідношення, виражені у вигляді функції якої-небудь зручної пари змінних величин, на зразок PO2 і Ps2, ми можемо, при бажанні, перерахувати отримані відношення, виразивши їх у вигляді функції інших газів. Для цього досить скласти реакції взаємодії між початково прийнятими і новими змінними.
Стійкість води
З всіх хімічних співвідношень найбільший інтерес для геологів має стійкість води. Передбачаючи існування рівноваги між водою і продуктами її дисоціації - воднем і киснем, можна написати
(1в) 2H2Oрідина<=>2H2газ+O2газ
Константа рівноваги цієї реакції рівна:
![]()
(2в)
але для майже чистої води [H2O]=1, і тому
(3в) P2H2×PO2=K
Співвідношення вільних енергій для рівняння (1в) буде наступним:
(4в) DZ°реакції=DZ°H2 + DZ°O2 - DZ°H2O = (0) + (0) - (-113,4) = +113,4
Тепер, виходячи із залежності між стандартною вільною енергією реакції і константою рівноваги, за якою DZ°реакції= –1,364×lgkP, визначаємо
113,4=–1,364×lgkP; kP=10-83,1
Тобто
(6в) P2H2×PO2=10-83,1
Таким чином, ступінь дисоціації води на водень і кисень при кімнатній температурі зневажливо мала. Проте, припускаючи наявність рівноваги, для характеристики меж стійкості води можна використовувати парціальні тиски кисню і водню.
Я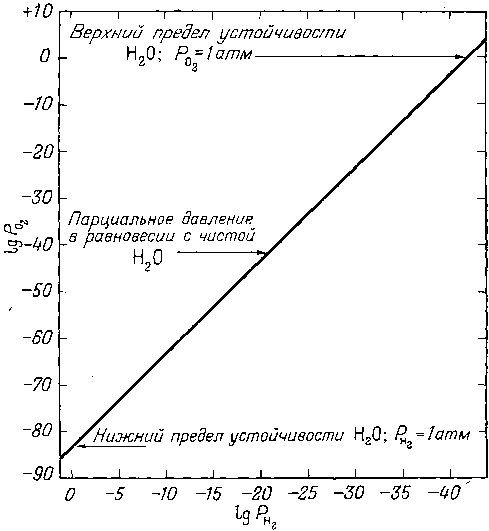 кщо
парціальний тиск одного з газів (водню
або кисню) в умовах земної поверхні
перевищить 1 атм,
тобто буде більшим, ніж атмосферний
тиск, то з води почне виділятися інший
газ (кисень або водень відповідно), таким
чином, вода буде розкладатися і постачати
(в атмосферу) додаткові кількості кисню
і водню. Якщо PO2=1,
то P2H2=10-83,1,
а PH2
=10-41,5
кщо
парціальний тиск одного з газів (водню
або кисню) в умовах земної поверхні
перевищить 1 атм,
тобто буде більшим, ніж атмосферний
тиск, то з води почне виділятися інший
газ (кисень або водень відповідно), таким
чином, вода буде розкладатися і постачати
(в атмосферу) додаткові кількості кисню
і водню. Якщо PO2=1,
то P2H2=10-83,1,
а PH2
=10-41,5
Якими б ні були окремо задані парціальні тиски водню або кисню, рівноважне їх відношення (з водою) буде цілком визначеним. Для подальшого викладу доцільно побудувати графік залежності PO2 від PH2 при рівновазі з водою: якщо відомий тиск одного з цих газів, то тиск іншого можна визначити, не вдаючись до спеціальних обчислень (Рис. 5.1).
Рисунок 5.1 - Парціальні тиски кисню і водню в умовах рівноваги з водою при 25°C і приблизно 1 атм загального тиску.
