
- •2. Існують три основні аспекти геохімічних досліджень:
- •3. Прикладні аспекти геохімічних досліджень:
- •7. Основні джерела інформації про склад Всесвіту. Космічна розповсюдженість елементів.
- •8. Будова ядер атомів як чинник що визначає поширеність елементів та їх ізотопів
- •9. Походження та поширеність елементів в Сонячній системі.
- •10. Геохімія планет земної групи (Меркурій, Венера,Земля, Марс).
- •11. Метеорити, їх склад та класифікація.
- •12.Геохімія Місяця. Значення досліджень складу місячних порід для вирішення питань походження Землі.
- •13. Значення вивчення складу метеоритів для дослідження глибинних геосфер Землі.
- •14. Сучасні уявлення щодо походження і складу Землі
- •16. Розповсюдженість хімічних елементів в мантії та ядрі Землі. Моделі складу ядра.
- •17. Розповсюдженість хімічних елементів в земній корі.
- •18. Розсіяний та концентрований стан хімічних елементів в природі.
- •Поняття про кларки та методи їх оцінки. Коефіцієнти розсіяння та концентрації. Основний геохімічний закон Ферсмана- Гольшмідта.
- •26. Фактори, що контролюють міграцію та розподіл елементів в геосферах, взаємозв*язок між ними.
- •27. Основні методологічні засади геохімії радіогенних ізотопів.
- •28. Застосування радіоактивних ізотопів при вирішенні питань петрогенезису магматичних порід
- •29. Застосування радіогенних ізотопів при дослідженні водних систем та осадових утворень
- •30. Використання радіогенних ізотопів при визначенні віку порід
- •31. Радіоактивний розпад, як фактор, що контролює розподіл елементів.
- •32. Основні методологічні засади геохімії стабільних ізотопів
- •33. Залежність розподілу ізотопів від температури. Ізотопні геотермометри
- •35. Розподіл ізотопів в біологічних системах
- •36. Використання ізотопів кисню та водню при вирішенні питань петрогенезису порід.
- •37. Чинники що контролюють розподіл ізотопів сірки в геохімічних системах.
- •38. Інформативність вивчення розподілу ізотопів сірки при вирішенні питань петрогенезису гідротермальних систем.
- •39. Структура силікатного розплаву. Основні засади теорії полімерів.
- •41. Структурний контроль розподілу елементів в твердих тілах.
- •42. Використання закону діючих мас в геохімії.
- •43. Фугітивність і активність, їх значення для геохімії.
- •46. Побудова діаграм стійкості мінералів як функції парціального тиску газів.
- •Стійкість води
- •47. Побудова діаграм стійкості мінералів в координатах Eh-pH
- •55. Гідротермальні геохімічні системи
- •56. Метаморфогенні геохімічні бар'єри
- •57.Геохімічна характеристика пегматитів.
- •58. Геохімія ультраосновних магматичних порід
- •59. Геохімія основних магматичних порід
- •60. Геохімія гранітоїдів
- •61. Металогенічна спеціалізація магматичних порід.
- •62. Геохімія магматичних порід лужного ряду
- •65. Геохімічна роль живої речовини.
- •66. Геохімія атмосфери
- •67. Геохімія гідросфери
- •68. Геохімічні особливості магматогенних систем
- •69. Геохімія біосфери
26. Фактори, що контролюють міграцію та розподіл елементів в геосферах, взаємозв*язок між ними.
Причини міграції хімічних елементів дуже різноманітні і, по А.Е.Ферсману, умовно можуть бути зведені до двох основних груп чинників:
1) зовнішні чинники міграції, які визначають термодинамічну обстановку міграції
2) внутрішні чинники, пов’язані із властивостями самих атомів хімічних елементів і їх з’єднань.
Чинники, що впливають на переміщення елементів: фізичні властивості, радіоактивність, електричні властивостію. Найбільш вагоме значення мають зовнішні чинники, це такі як: параметри – тиск і температура, концентрація речовин, кислотно – лужні і окисно відновні параметри, явище сорбції, наявність живих організмів, насиченість системи енергією, енергія фазових перетворень.
Взаємодія, протиріччя між цими двома групами чинників і є основною причиною процесів геохімічної міграції. Фізико-хімічні процеси спрямовані на приведення всієї земної кори і її складових до стану термодинамічної рівноваги, а внутрішньопланетні, космічні, ядерні процеси, підпорядковуючись своїм законам, постійно порушують це спрямування, призводять до круговоротів, переміщення, перегрупування, перерозподілу хімічних елементів у земній корі.
Основними характеристиками елементів, які необхідно враховувати при вивченні міграції хімічних елементів, є: розмір атому або іону, потенціал іонізації і спорідненість до електрону, характер хімічного зв’язку, валентність, координаційне число, енергія кристалічної гратки, ізоморфізм. Первинні з них: розміри атомів, потенціали іонізації, спорідненість до електрона, валентність; вторинні - атомні й іонні радіуси, координаційне число, ізоморфізм, енергія кристалічної гратки.
(Рис 1 – Зв’язок властивостей атомів з іонним радіусом).
Розміри атомів залежать від характеру зв’язку і координації, а також від будівлі, заряду і маси ядер атомів. У геохімії їх прийнято характеризувати атомними радіусами атомів і іонів.
А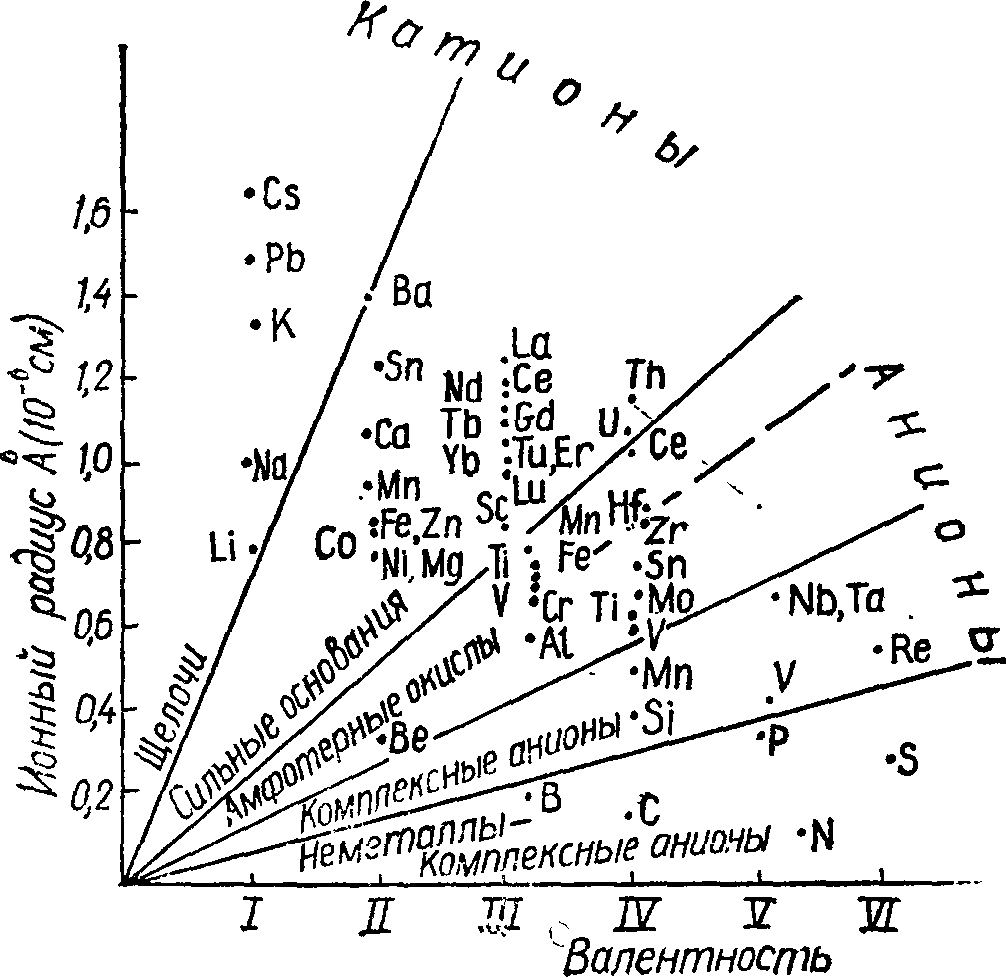 томний
об’єм - це
об’єм грам-атому в кубічних сантиметрах,
тобто простір, що зайнято 6,02*1023
атомами
(разом із пустотами). Розглядаючи
кристалічні структури як найщільніші
шарові упаковки, відстань між центрами
двох сусідніх атомів або іонів того
самого елемента можна вважати рівною
сумі їх радіусів в ангстремах
(10-10
м).
Експериментальні рентгеноструктурні
вимірювання цих відстаней у кристалічних
структурах дозволили обчислити ефективні
радіуси. Вони є однією з характерних
констант атомів і іонів, обумовлених
зарядом ядра атому, числом і будовою
електронних оболонок.
томний
об’єм - це
об’єм грам-атому в кубічних сантиметрах,
тобто простір, що зайнято 6,02*1023
атомами
(разом із пустотами). Розглядаючи
кристалічні структури як найщільніші
шарові упаковки, відстань між центрами
двох сусідніх атомів або іонів того
самого елемента можна вважати рівною
сумі їх радіусів в ангстремах
(10-10
м).
Експериментальні рентгеноструктурні
вимірювання цих відстаней у кристалічних
структурах дозволили обчислити ефективні
радіуси. Вони є однією з характерних
констант атомів і іонів, обумовлених
зарядом ядра атому, числом і будовою
електронних оболонок.
Для одних і тих самих елементів величини іонних радіусів можуть змінюватись в залежності від типу хімічного зв’язку, заряду (валентності) іона, природи взаємодіючих атомів і координаційного числа. Із збільшенням позитивного заряду (тобто зі зменшенням числа валентних електронів у його оболонці) іонні радіуси зменшуються, із збільшенням негативного заряду (тобто зі збільшенням кількості валентних електронів) вони збільшуються. Наприклад:
Mn2+ |
Mn3+ |
Mn4+ |
0,91 |
0,70 |
0,52 |
За величиною радіусів іонів хімічні елементи у таблиці Менделєєва розташовуються цілком закономірно: у малих періодах по горизонтальних рядах зліва на право вони зменшуються, по вертикальних групах зверху вниз - збільшуються. Тому по діагональних рядах вони рівні або близькі, а це полегшує процеси заміщення різноманітних елементів у природних з’єднаннях - мінералах (мал. 2).
Із збільшенням радіусів іонів (за інших рівних умов) збільшується розчинність з’єднань, зменшується їхня міцність і твердість, знижуються точки плавлення.
Потенціалом іонізації називається величина енергії, яку необхідно затратити, щоб відірвати електрон і видалити його в безкінечність. Залежить потенціал іонізації від заряду ядра, ефективного радіусу атому і типу зовнішньої електронної оболонки. Збільшення заряду ядра призводить (при рівних інших умовах) до підвищення потенціалів іонізації. Елементи з великими потенціалами іонізації (і відповідно з малими розмірами атомних радіусів) утворюють атомні й атомно-іонні гратки, які більш стійкі, чим іонні.
Подібність радіусів іонів (як і атомів) певною мірою обумовлює подібність шляхів міграції. Спроможність атомів до міграції збільшується з переходом від атомів із середнім розміром радіусу до крайнього. Близькість розмірів іонів є одним із найважливіших умов ізоморфізму в кристалічних гратках з іонним зв’язком. Проте ізоморфізм можливий тільки у випадку подібності хімічних зв’язків.
Серед хімічних зв’язків між елементами в кристалах розрізняють іонні, атомні (ковалентні), металеві і вандерваальсівські зв’язки. Той або інший тип зв’язків визначається сумарною спроможністю кожного атома до утримання свого і приєднання чужого електрона, або електровід’ємністю (электроотрицательностью). Відповідно до А.С.Поварєнних [10], електровід’ємність - це енергія з якою даний атом притягує валентні електронів при з’єднанні його з іншими атомами: Е = In /n + Г, де Е – електровід’ємність; In - потенціал іонізації атому до визначеного валентного стану; п - валентність атомів у з’єднанні; Г - спорідненість до електрону.
Чим вища різниця електровід’ємностей атомів двох взаємодіючих елементів, тим сильніше виражається тенденція до перетягування електронів одним із них (більш електровід’ємним) від іншого (менше електровід’ємного) з утворенням іонного зв’язку між ними. Із зменшенням різниці електровід’ємностей взаємодіючих елементів збільшується частка атомного (ковалентного) зв’язку в з’єднанні. Уявлення про порядок величин електровід’ємностей (ЕО) дає табл. 1.
Мінімальними значеннями електровід’ємності характеризуються атоми лужних металів, максимальними - галоїди. У з’єднаннях їх один з одним утворюється істотно іонний зв’язок. За домінування іонного зв’язку, в іонів виникає конфігурація електронних оболонок типу благородних газів (восьми електронна оболонка) або типу купро (з вісімнадцятьма електронними оболонками). Іони у кристалічній гратці утримуються силами електростатичного притяжіння.
Для рідин, газів, органічних сполук характерні атомні, або ковалентні, зв’язки. У цьому випадку утворюються атомні гратки, в яких зв’язок між атомами здійснюється шляхом спільного володіння одним або кількома електронами. Зв’язок у цьому випадку здійснюється на основі квантово-механічної взаємодії (електронними силами), сутність якого полягає в заповненні зовнішніх електронних прошарків з імітацією того або іншого типу закінченої електронної оболонки.
Найбільш поширеними у природі є кристалічні тіла з проміжним іонно-атомним зв’язком.. Наближення зв’язку до того або іншого граничного типу залежить від розходження в електровід’ємності взаємодіючих атомів.
Характер зв’язків грає важливу роль у процесах магматичної кристалізації, у диференціації і міграції хімічних сполук. Так, за характером зв’язків В.І.Лебедєв поділяє хімічні елементи на дві групи: 1) елементи, що утворюють іонні зв’язки, і 2) елементи, що утворюють ковалентні або металеві зв’язки.
Структури іонних і атомних кристалів є координаційними, тому що вузли в них займають визначені атоми або іони. Можуть бути прості (NaCl, KCl, Zn, FeS2 тощо) і комплексні з’єднання, коли наряду із простими іонами вузли кристалічного штахету займають комплексні іони або радикали, наприклад Ca(CO3), Mg(SiO3), Fe(WO4) тощо.
Металеві зв’язки характерні для металів, деяких сульфідів, арсенідів і інших з’єднань. При цьому типі зв’язку частина валентних електронів є загальними для всіх атомів у даному з’єднанні. Тому вони можуть вільно пересуватися, нагадуючи рух атомів в газі. Зв’язок між іонами здійснюється притяжінням між позитивно зарядженими іонами атомів і всіх електронів. Незакріпленість електронів обумовлює високу електро- і теплопровідність, нелетючість, твердість гратки мінералів.
Міжмолекулярні, або вандерваальсівські, зв’язки існують між окремими молекулами речовин, усередині яких зв’язки між атомами або іонами можуть бути іонного або атомного типу. Молекулярні зв’язки дуже слабкі і здійснюються так називаними вандерваальсівськими силами, тобто силами орієнтаційними, дисперсійними й індукційними. Найбільш поширені ці зв’язки в деяких кристалічних речовинах, що утворюються при пневматолітових і гіпергенних процесах. Найбільш слабким хімічним і сильним міжмолекулярним зв’язком слід вважати водневий зв’язок. Його енергія вище вандерваальсівської, але нижче хімічної. Здійснюється цей зв’язок проникаючим практично в будь-яку атомну структуру іоном водню Н+.
Іонний, атомний, металевий і міжмолекулярний зв’язки в чистому виді виявляються лише в граничних випадках. У реальних кристалічних гратках мінералів проявляються різноманітні комбінації цих зв’язків.
Координаційним числом (КЧ) атому (іону) називається число безпосередньо оточуючих його інших (рідше - аналогічних) атомів (іонів) у структурі мінералу, відстані між центрами яких і центром оточеного атому приблизно рівні. Координаційним числом прийнято вважати число атомів або атомних груп, безпосередньо приєднаних до даного центрального атому в комплексному з’єднанні.
Міцність хімічного зв’язку залежить від міжатомних відстаней (d), валентності атомів і ступеню ковалентності зв’язку. Чим менше координаційне число, тим міцніший зв’язок атомів (іонів). Для випадку одиничної валентності рівняння, що зв’язує координаційне число (КЧ) із міжатомними відстанями і ковалентністю зв’язку (E), може бути записане як КЧ = d/E. Найбільше поширеним КЧ кристалічних граток є 6, потім у порядку зниження поширення слідують 4, 8 і 12.
Структура кристалу визначається тенденцією складаючих її атомів зайняти положення, що відповідає мінімуму їх загальної потенційної енергії. Цю тенденцію виражають за допомогою введення поняття енергії гратки. Ця енергія вимірюється роботою, яку треба затратити, щоб розірвати грам-молекулу речовини на іони що її складають. Енергія кристалічних граток різна для кристалів із різним хімічним зв’язком. Вона визначається числом структурних одиниць (іонів) кристалу, їх валентностями, міжатомними відстанями і ступенем іонності хімічного зв’язку.
Енергія гратки залежить від балансу таких чинників:
а) електростатичних сил, що діють між іонами протилежного заряду і викликають їх взаємне притяжіння, сила якого спадає пропорційно квадрату відстані;
б) міжмолекулярних сил відштовхування, що дуже швидко зменшуються з відстанню.
Взаємодія притяжіння й відштовхування призводить до рівноважного стану з мінімальною потенційною енергією, і якщо сумувати цю енергію по всіх іонах, одержимо величину, чисельно рівну енергії кристалічної гратки.
Енергія кристалічних речовин іонних з’єднань, що не містять сильно поляризуючих сил, або здатних до поляризації іонів, зростає зі збільшенням числа структурних одиниць (іонів) і їх валентності, а, отже, і зі зменшенням їхніх розмірів. Для бінарних з’єднань енергія гратки розраховується по рівнянню Борна – Ланде:
U![]() =
(1/r)*N*A*Zc*Za*(1-1/n)
=
(1/r)*N*A*Zc*Za*(1-1/n)
де U - енергія гратки; N - число Авогадро; А - константа Маделунга, характерна для кожного типу кристалічної структури; Za, Zc - заряди аніону і катіону; r - найкоротша відстань між аніоном і катіоном; п - чинник, що враховує міжядерне відштовхування (п звичайно має значення, близьке до 10). За А.Ф.Капустинським
U= [287,2/(rk-ra)]*Wk*Wa*Sn*[1-0,345/(rk-ra)]
де Wk, Wa - валентності катіону та аніону; rk, ra - радіуси катіону і аніону; Sn - число атомів у хімічній молекулі.
О.Є.Ферсман одним із перших показав яке значення енергія кристалічної гратки має для характеристики процесів, обчислив енергетичні коефіцієнти окремих катіонів і аніонів, увів поняття «ЕК» і «ВЕК». ЕК (енергетичний коефіцієнт) - це енергія, що виділяється іоном при утворенні кристалічного гратки з розсіяних у безкінечності іонів, у розрахунку на 1 моль у великих калоріях при абсолютному нулі. ЕК є емпіричною константою елементу, що демонструє внесок елементу в енергію гратки його з’єднань. Сума ЕКів, що входять у з’єднання іонів, дає ВЕК (валентний енергетичний коефіцієнт) і відповідає тій же енергії в розрахунку на одиницю зв’язку (валентності).
А.Е.Ферсманом був встановлений закон послідовності геохімічної кристалізації: послідовність кристалізації слідує зниженню енергії кристалічної гратки (наступними дослідженнями був встановлений обмежений характер цього закону, що переважно виявляється для простих випадків). Як показав Г.Г.Лейммлейн, реакційний ряд утворення мінералів із магматичних розплавів Н.Л.Боуэна (олівін -піроксен - амфіболи - біотит - польовий шпат - кварц) загалом відповідає послідовному зниженню енергії кристалічної гратки, нормованої на число атомів (Si + А1).
