
- •1. Первое начало термодинамики.
- •3.Работа газа при Адиабатном процессе.
- •5. Теплоемкость твердых тел. Закон Дюлонга и Пти.
- •6. Круговой процесс (цикл). Обратимые и необратимые процессы.
- •7. Круговой процесс. Цикл Карно (прямой). Схема работы тепловой машины.
- •8. Круговой процесс. Цикл Карно (обратный). Схема работы холодильной машины.
- •13. Реальные газы. Уравнение Ван–дер–Ваальса.
- •14.Внутренняя энергия ван–дер–ваальсовского газа.
- •18. Уравнение Клапейрона–Клаузиуса.
1. Первое начало термодинамики.
Кол-во энергии, передаваемое одним телом другому, опр-ся работой A, совершаемой друг над другом телами, кол-во энергии, переданное от тела к телу путем теплопередачи, опр-ся кол-ом тепла Q, отданного одним телом другому. Т.о, приращение внутр. энергии системы должно быть равно сумме совершенной над системой работы A’ и кол-ва сообщенного системе тепла Q:
U2 - U1 = Q + A’ (1)
Здесь U1 и U2 – начальное и конечное значения внутренней энергии системы. Обычно вместо работы А’, совершаемой внешними телами над системой, рассматривают работу А (равную –A’), совершаемую системой над внеш. телами. получим: Q = U2 – U1 + A. Это уравнение выражает закон сохранения энергии и представляет собой содержание первого закона (начала) термодинамики. Словами его можно выразить следующим образом: кол-во тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Процессы, в кот. один из параметров состояния вещ-ва остается неизменным наз-ся изопроцессами. Для идеального газа:
1). Изотермический процесс. По умолчанию во всех изопроцессах mгаза = const.
T=const ∆U=0; Q=A
2). Изохорный процесс:
V=const A=0; Q=∆U
3). Изобарный процесс:
p=const Q=∆U+A
4). Адиабатный процесс: процесс без теплообмена с внешней средой.
Q=0 -A=∆U.
На практике адиабатный процесс имеет место, если изменение параметров состояния газа происходит достаточно быстро (за небольшое время система получает из вне также небольшое кол-во теплоты).
2. Удельная и мол-ая теплоемкость. связь Cp и Cv м\ду собой.
Пусть тело, получив кол-во теплоты dQ, нагрелось на dT градусов, то теплоемкость тела:
![]()
Теплоемкостью тела называется физическая величина, численно равная кол-ву теплоты, кот. надо сообщ. телу, чтобы нагреть его на 1 градус. Теплоемкость отнесенная к единице массы тела, наз-ся удельной теплоемкостью:
![]() [Q]=Дж/кг*К
[Q]=Дж/кг*К
Молярная теплоемкость:
![]()
![]()
Найдем молярную теплоемкость идеал. газа. Согласно I начала термодинамики Q=∆U+A; работа зависит не только от состояния, но и от пути перехода, т.е. теплота также не является функцией состояния вещества.
Но это означает, что теплоемкость также не является функцией состояния вещества и зависит пути перехода от одного состояния в др. Сущ-т бесконечно много видов теплоемкостей, ограничимся расчетом 2 видов теплоемкостей:
CV – при V=const
CP – при p=const
1). V=const
dQ=dU, т.к dA=0
![]()
![]()
![]()
2). p=const
dQ=dU+dA
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

3.Работа газа при Адиабатном процессе.
Работа, совершаемая при адиабатном изменении объема газа, может быть найдена по формуле:
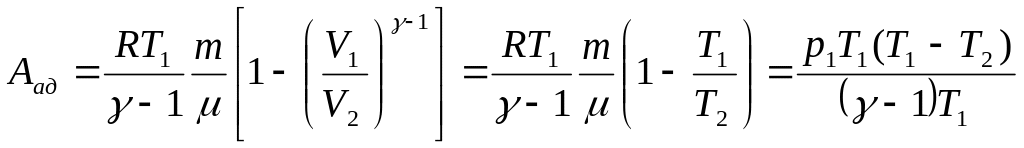
где:
p1 и V1 – давление и объем газа при T1.
5. Теплоемкость твердых тел. Закон Дюлонга и Пти.
В качестве модели
твердого тела рассмотрим правильно
построенную кристаллическую решетку,
в узлах которой частицы (атомы, ионы,
молекулы), принимаемые за материальные
точки, колеблются около своих положений
равновесия — узлов решетки — в трех
взаимно перпендикулярных направлениях.
Таким образом, каждой составляющей
кристаллическую решетку частице
приписывается три колебательных степени
свободы, каждая из которых, согласно
закону равнораспределения энергии по
степеням свободы, обладает энергией
kT. Внутренняя энергия моля твердого
тела
![]() где
Na-авог.
Na*k=R,пост.Больцмана.
Тогда теплоемкость ТВ.тела:
где
Na-авог.
Na*k=R,пост.Больцмана.
Тогда теплоемкость ТВ.тела:
![]()
Т.е мол-ая (атомная) теплоемкость хим-ки простых тел в крист-ом сост.одинакова(3R) и не зависит от температуры.Закон Дюлонга и Пти.
Если ТВ.тело
явл.хим-им соед-ем, то частиц в моле
не=n*Nа,
где n-число
атомов в молекуле. Т.о. мол-ая тепл-ть
ТВ.хим.соед.
![]() т.е.
= сумме атомных тепл-ей Эл-ов сост-их это
соед-ие.
т.е.
= сумме атомных тепл-ей Эл-ов сост-их это
соед-ие.
