
- •Предмет физики. Методы физического исследования: опыт, гипотеза.
- •2. Механическое движение как простейшая форма движения материи.
- •3. Элементы кинематики материальной точки.
- •4. Инерциальные системы отсчета. Динамика материальной точки и поступательного движения твердого тела.
- •5. Законы динамики материальной точки и системы материальных точек.
- •8. Энергия. Кинетическая энергия механической системы.
- •9. Теорема об изменении кинетической энергии. Работа переменной силы. Мощность.
- •10.Поле как форма материи. Понятие о градиенте скалярной функции координат.
- •11. Потенциальная энергия материальной точки во внешнем силовом поле и ее связь с силой, действующей на материальную точку. Потенциальная энергия системы.
- •12. Закон сохранения механической энергии. Диссипация энергии. Применение законов сохранения к столкновению упругих и неупругих тел. Энергия деформации.
- •13. Преобразования Галилея. Постулаты специальной теории относительности.
- •14. Преобразования Лоренца. Относительность длин и промежутков времени.
- •15. Интервал между событиями и его инвариантность по отношению к выбору инерциальной системы отсчета как проявление взаимосвязи пространства и времени.
- •16. Релятивистский закон сложения скоростей. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •17. Релятивистское выражение для кинетической энергии. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы.
- •18. Элементы кинематики вращательного движения. Угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями точек вращающегося тела.
- •19. Момент силы относительно оси. Теорема Гюйгенса-Штейнера.
- •20. Уравнение динамики вращательного движения твердого тела относительно неподвижной оси. Кинетическая энергия вращающегося тела.
- •21. Закон сохранения момента импульса вращательного движения твердого тела и его связь с изотропностью пространства.
- •22. Неинерциальные системы отсчета. Силы инерции.
- •23. Гармонические механические колебания. Энергия гармонических колебаний.
- •24. Дифференциальное уравнение гармонических колебаний. Маятники.
- •25. Сложение гармонических колебаний. Биения.
- •26. Дифференциальное уравнение затухающих колебаний и его решение. Дифференциальное уравнение вынужденных колебаний и его решение.
- •27. Амплитуда и фаза вынужденных колебаний. Понятие о резонансе.
- •28. Свойства жидкостей и газов. Уравнения движения жидкости. Идеальная и вязкая жидкости. Гидростатика несжимаемой жидкости.
- •29. Стационарное движение идеальной жидкости. Уравнение Бернулли.
- •30. Гидродинамика вязкой жидкости. Коэффициент вязкости. Формула Пуазейля.
- •31. Гидродинамическая неустойчивость. Турбулентность.
- •32. Упругие натяжения. Закон Гука. Модуль Юнга. Деформации растяжения и сжатия.
- •33. Статистический и термодинамический методы исследования.
- •34. Экспериментальные газовые законы. Уравнение Менделеева-Клапейрона.
- •35. Основное уравнение молекулярно-кинетической теории идеального газа.
- •36. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование термодинамической температуры.
- •37. Число степеней свободы молекулы.
- •38. Закон Максвелла для распределения молекул идеального газа по скоростям.
- •39. Барометрическая формула. Закон Больцмана для распределения.
- •40. Среднее число столкновений и средняя длина свободного пробега молекул.
- •41. Законы диффузии, теплопроводности и внутреннего трения.
- •42. Внутренняя энергия идеального газа. Работа газа при изменении его объема. Количество теплоты.
- •43. Первое начало термодинамики.
- •44. Теплоемкость. Зависимость теплоемкости идеального газа от вида процесса.
- •45. Круговой процесс (цикл). Обратимые и необратимые процессы. Тепловые двигатели и холодильные машины.
- •46. Цикл Карно и его кпд для идеального газа.
- •47. Второе начало термодинамики. Независимость кпд цикла Карно от природы рабочего тела.
- •48. Энтропия идеального газа. Статистическое толкование второго начала термодинамики.
- •49. Отступления от законов идеальных газов. Реальные газы.
- •50. Уравнение Ван-дер-Ваальса. Сравнение изотерм Ван-дер-Ваальса с экспериментальными изотермами.
- •51. Критическое состояние. Внутренняя энергия реального газа.
- •52. Фазовые переходы I и II рода. Особенности жидкого и твердого состояний вещества.
48. Энтропия идеального газа. Статистическое толкование второго начала термодинамики.
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное
количество теплоты, сообщаемое телу
на бесконечно малом участке процесса,
равно Q/T.
Строгий теоретический анализ показывает,
что приведенное количество теплоты,
сообщаемое телу в любом
обратимом круговом процессе,
равно нулю:

Из
равенства нулю интеграла взятого по
замкнутому контуру, следует, что
подынтегральное выражение Q/T
есть полный дифференциал некоторой
функции, которая определяется только
состоянием системы и не зависит от
пути, каким система пришла в это
состояние. Таким образом,
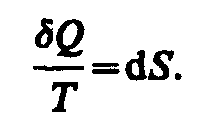
Функция состояния, дифференциалом которой является Q/T, называется энтропией и обозначается S.
следует, что для обратимых процессов изменение энтропии. В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает.
Выражения
(57.3) и (57.4) относятся только к замкнутым
системам,
если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом. Соотношения
можно представить в виде неравенства
Клаузиуса
![]() т.
е. энтропия
замкнутой системы
может либо
возрастать,
либо
оставаться постоянной.
т.
е. энтропия
замкнутой системы
может либо
возрастать,
либо
оставаться постоянной.
Где подынтегральное выражение и пределы интегрирования определяются через величины, характеризующие исследуемый процесс. Формула определяет энтропию лишь с точностью до аддитивной постоянной. Физический смысл имеет не сама энтропия, а разность энтропий.
 т.
е. изменение энтропии S12
идеального газа при переходе его из
состояния 1
в состояние 2
не зависит от вида процесса перехода
12.
т.
е. изменение энтропии S12
идеального газа при переходе его из
состояния 1
в состояние 2
не зависит от вида процесса перехода
12.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему.
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
49. Отступления от законов идеальных газов. Реальные газы.
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлении. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В XX в., по мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
На расстоянии r=r0 результирующая сила F = 0, т.е. силы притяжения и отталкивания уравновешивают друг друга. Элементарная работа A силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
![]()
