
- •Предмет физики. Методы физического исследования: опыт, гипотеза.
- •2. Механическое движение как простейшая форма движения материи.
- •3. Элементы кинематики материальной точки.
- •4. Инерциальные системы отсчета. Динамика материальной точки и поступательного движения твердого тела.
- •5. Законы динамики материальной точки и системы материальных точек.
- •8. Энергия. Кинетическая энергия механической системы.
- •9. Теорема об изменении кинетической энергии. Работа переменной силы. Мощность.
- •10.Поле как форма материи. Понятие о градиенте скалярной функции координат.
- •11. Потенциальная энергия материальной точки во внешнем силовом поле и ее связь с силой, действующей на материальную точку. Потенциальная энергия системы.
- •12. Закон сохранения механической энергии. Диссипация энергии. Применение законов сохранения к столкновению упругих и неупругих тел. Энергия деформации.
- •13. Преобразования Галилея. Постулаты специальной теории относительности.
- •14. Преобразования Лоренца. Относительность длин и промежутков времени.
- •15. Интервал между событиями и его инвариантность по отношению к выбору инерциальной системы отсчета как проявление взаимосвязи пространства и времени.
- •16. Релятивистский закон сложения скоростей. Релятивистский импульс. Основной закон релятивистской динамики материальной точки.
- •17. Релятивистское выражение для кинетической энергии. Взаимосвязь массы и энергии. Соотношение между полной энергией и импульсом частицы.
- •18. Элементы кинематики вращательного движения. Угловая скорость и угловое ускорение, их связь с линейными скоростями и ускорениями точек вращающегося тела.
- •19. Момент силы относительно оси. Теорема Гюйгенса-Штейнера.
- •20. Уравнение динамики вращательного движения твердого тела относительно неподвижной оси. Кинетическая энергия вращающегося тела.
- •21. Закон сохранения момента импульса вращательного движения твердого тела и его связь с изотропностью пространства.
- •22. Неинерциальные системы отсчета. Силы инерции.
- •23. Гармонические механические колебания. Энергия гармонических колебаний.
- •24. Дифференциальное уравнение гармонических колебаний. Маятники.
- •25. Сложение гармонических колебаний. Биения.
- •26. Дифференциальное уравнение затухающих колебаний и его решение. Дифференциальное уравнение вынужденных колебаний и его решение.
- •27. Амплитуда и фаза вынужденных колебаний. Понятие о резонансе.
- •28. Свойства жидкостей и газов. Уравнения движения жидкости. Идеальная и вязкая жидкости. Гидростатика несжимаемой жидкости.
- •29. Стационарное движение идеальной жидкости. Уравнение Бернулли.
- •30. Гидродинамика вязкой жидкости. Коэффициент вязкости. Формула Пуазейля.
- •31. Гидродинамическая неустойчивость. Турбулентность.
- •32. Упругие натяжения. Закон Гука. Модуль Юнга. Деформации растяжения и сжатия.
- •33. Статистический и термодинамический методы исследования.
- •34. Экспериментальные газовые законы. Уравнение Менделеева-Клапейрона.
- •35. Основное уравнение молекулярно-кинетической теории идеального газа.
- •36. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование термодинамической температуры.
- •37. Число степеней свободы молекулы.
- •38. Закон Максвелла для распределения молекул идеального газа по скоростям.
- •39. Барометрическая формула. Закон Больцмана для распределения.
- •40. Среднее число столкновений и средняя длина свободного пробега молекул.
- •41. Законы диффузии, теплопроводности и внутреннего трения.
- •42. Внутренняя энергия идеального газа. Работа газа при изменении его объема. Количество теплоты.
- •43. Первое начало термодинамики.
- •44. Теплоемкость. Зависимость теплоемкости идеального газа от вида процесса.
- •45. Круговой процесс (цикл). Обратимые и необратимые процессы. Тепловые двигатели и холодильные машины.
- •46. Цикл Карно и его кпд для идеального газа.
- •47. Второе начало термодинамики. Независимость кпд цикла Карно от природы рабочего тела.
- •48. Энтропия идеального газа. Статистическое толкование второго начала термодинамики.
- •49. Отступления от законов идеальных газов. Реальные газы.
- •50. Уравнение Ван-дер-Ваальса. Сравнение изотерм Ван-дер-Ваальса с экспериментальными изотермами.
- •51. Критическое состояние. Внутренняя энергия реального газа.
- •52. Фазовые переходы I и II рода. Особенности жидкого и твердого состояний вещества.
38. Закон Максвелла для распределения молекул идеального газа по скоростям.
По молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой m0 в газе, находящемся в состоянии равновесия при Т = const, остается постоянной и равной <vкв> =3kT/m0. Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону.
При выводе закона распределения молекул по скоростям Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN (v)/N, скорости которых лежат в интервале от v до v+dv, т. е. Откуда f(v)=dN(v)/Ndv
Применяя
методы теории вероятностей, Максвелл
нашел функцию f(v)
—
закон
для распределения молекул идеального
газа по скоростям:

Видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т). Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью.

Из формулы (44.2) следует, что при повышении температуры максимум функции распределения молекул по скоростям сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
39. Барометрическая формула. Закон Больцмана для распределения.
При выводе основного уравнения молекулярно-кинетической теории газов и макcсвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул — с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте А равно р, то на высоте h + dh оно равно p+dp. Разность давлений р и p + dp равна весу газа, заключенного в объеме цилиндра высотой Ah с основанием площадью, равной единице площади: р-(p+dp)=gh, где — плотность газа на высоте h.
Следовательно, dр=-gdh Выражение (45.3) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту.

Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
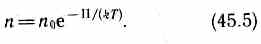 П=U-U0
П=U-U0
Выражение (45.5) называется распределением Больцмана во внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Скорости, характеризующие состояние газа: 1) наиболее вероятная vв=2RT/М; 2) средняя <v>=8RT/(М)=1,13vв; 3) средняя квадратичная <vкв> =3RT/М =1,22vв.
Таким образом, функция распределения молекул по энергиями теплового движения


