
- •Производные углеводородов и простейших гетероциклических соединений
- •7. Полимеры получают с помощью реакций двух основных типов — полимеризации и поликонденсации.
- •17. Галогенопроизводные углеводородов
- •21. Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
- •1. Действие водоотнимающих средств
- •2. Действие галоидных алкилов на алкоголяты.
- •6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
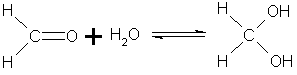
Реакция обратима, положение равновесия зависит от реакционной способности карбонильного соединения. Например, формальдегид гидратирован на 100%, менее активный ацетальдегид — только на 51%. Кетоны в водных растворах практически не гидратируются.
Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности, они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать связи С-С в их молекуле.
7. Реакция "серебряного зеркала" — это окисление альдегидов аммиачным раствором оксида серебра. В водном растворе аммиака оксид серебра образует комплексное соединение
[Аg(NН3)2]ОН, при действии которого на альдегид происходит окислительно-восстановительная реакция с образованием соли аммония:
R-CH=0 + 2[Ag(NH3)2]OH → RCOONH4+ 2Ag↓+ 3NH3 + H2O (2)
Иногда эту реакцию записывают в упрощенном виде:
NH3 R-CH=O + Ag2O →R-COOH + 2Ag↓.
8. При окислении альдегидов гидроксидом меди (II) последний превращается в желтый гидроксид меди (I), который при нагревании разлагается с образованием оксида меди (I) красного цвета:
t
СН3-СН=О + 2Сu(ОН)2 → СН3-СООН + Cu2O↓ + 2Н2О.
Данная реакция и реакция серебряного зеркала являются качественными реакциями на альдегиды. Реакции поликонденсации
9. Для альдегидов характерны реакции поликонденсации.
Применение. Формальдегид используют для получения полимерных материалов (фенолформальдегидных смол). В водном растворе формальдегида (формалине) хранят анатомические препараты. Ацетальдегид применяют для получения различных соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилового эфира уксусной кислоты и т.д. Ацетон используют как растворитель для лаков, красок и т.д.
25. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название "жирные" эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Полезно подчеркнуть следующее важное обстоятельство, часто ускользающее от внимания читателей: карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами. Очень сильными органическими кислотами являются сульфокислоты — органические соединения, содержащие сульфогруппу -SО3Н (например, метансульфокислота СН3SО3Н). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ ( например, получение фенолов из сульфокислот ).
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание "карбоновая кислота" и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса "диовая" и слова "кислота". Например, этандиовая (щавелевая) кислота (НООС-СООН).
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания "дикарбоновая кислота". Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
Физические свойства. Насыщенные алифатические монокар-боновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Физические свойства карбоновых кислотНазвание кислоты Химическая
формула tпл tкип Чсло
Двойных
Связей
Муравьиная(метановая)
HCOOH
8
101
0
Уксусная(этановая)
CH3COOH
17
118
0
Пропионовая(пропановая)
CH3CH2COOH
-22
141
0
Акриловая(пропеновая)
CH2=CH-COOH
12
141
1
Капроновая(гексановая)
CH3(CH2)4COOH
-2
205
0
Пальмитиновая
(гексадециловая) C15H31COOH 64 215 0
Стеариновая(октадециловая)
C17H35COOH
70
232
0
Олеиновая
(цис-октадецен-9-овая) C17H33COOH 14 228 1
Линолевая
(октадекадиен-9,12-овая) C17H31COOH
-5
230
2
Линоленовая (октадекатриен-9,12,15-овая) C17H29COOH
-11
230
3
Бензойная(бензолкарбоновая)
C6H5COOH
122
249
0
Щавелевая(этандиовая)
HOOC-COOH
190
0
При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей — с ростом их числа соответствующие температуры уменьшаются.
Ненасыщенные кислоты при комнатной температуре являются, как правило, жидкостями.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
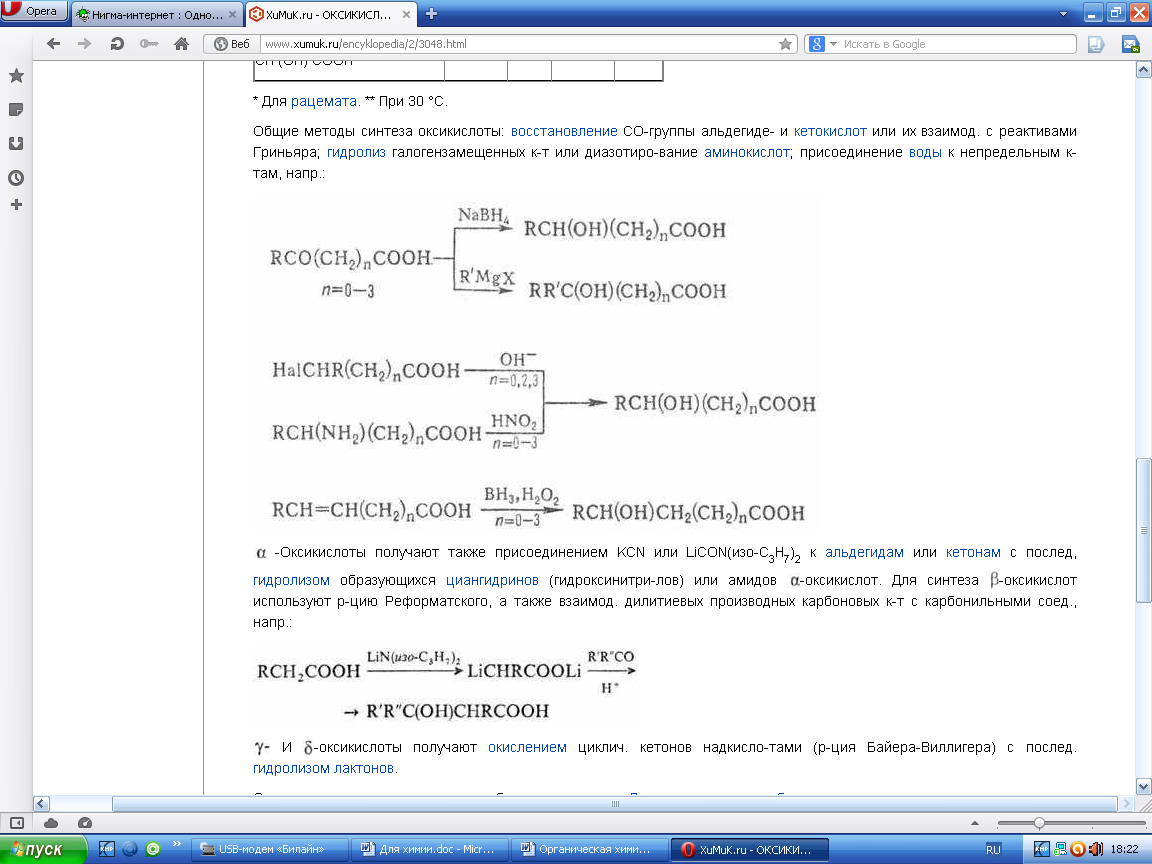
26. Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7. [O] [O]
R-CH2-OH → R-CH=O → R-CO-OH
спирт альдегид кислота
2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты: ЗNаОН
R-CCl3 → [R-C(OH)3] → R-COOH + Н2О
-3NaCl
3. Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН + NH4Cl.
4. Использование реактива Гриньяра по схеме:
Н2О
R-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br
5. Гидролиз сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH ,
R-COOK + HCl → R-COOH + KCl .
6. Гидролиз ангидридов кислот:
(RCO)2O + Н2О → 2RCOOH.
7. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой: 200 °С, Р H2SO4
NaOH + СО → HCOONa → НСООН
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 = 5С6Н5СООН + 3K2SO4 + 6MnSO4 + 14H2O.
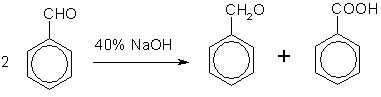
Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40—60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и соответственно фенилметанола (бензилового спирта):
27. Химические свойства. Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют:
RCOOH RCOO- + Н+
Тем не менее из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например, этановая (уксусная) кислота характеризуется константой диссоциации Ка = 1,7*10-5.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в значениях констант диссоциации Ka для ряда кислот. Кроме того, на силу кислоты оказывает влияние наличие сопряженной кратной связи.
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК + Н2О СН3СООН + КОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
3. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R—CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
R-CO-OH + РСl 5 → R-CO-Cl + РОСl3 + HCl.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-CO-OH + Р2О5 → (R-CO-)2O + 2НРО3.
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-CO-OH + Р2О5 → (R-CO-)2O + 2НРО3.
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-CO-Cl + Na-O-R' → R-CO-OR' + NaCl.
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
СН3-СО-Сl + CН3 → СН3-СО-CН2 + HCl.
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот: t°
CH3-COONH4 → CH3-CO-NH2 + Н2О
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов: Р205
CH3-CO-NH2 → CH3-C≡N + Н2О
Функциональные производные низших кислот - летучие жидкости. Все они легко гидролизуются с образованием исходной кислоты:
R-CO-X + Н2О →R-CO-OH + НХ.
В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, например:
R-CO-OR' + NaOH → R-CO-ONa + R'OH.
4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (а-атоме ): ркр
СН3-СН2-СООН + Вr2 → СН3-СНВr-СООН + НВr
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН-СООН + Н2 → СН3-СН2-СООН,
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН,
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН,
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН,
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
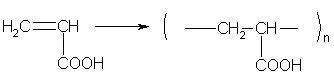
5. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды: 2[Н]
СН3СООН → СН3СНО + Н2О
4[Н]
СН3СООН → СН3СН2ОН + Н2О
6[Н]
СН3СООН → С2Н6 + 2Н20
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота: Н2SО4(конц)
НСООН → СО + Н2О
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию "серебряного зеркала":
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O,
или в упрощенном виде:
CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О.
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
6. Реакции декарбоксширования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С—С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью: t°
CH3-CH2-COONa + NaOH → С2Н6↑ + Na2CO3
Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования: 70°C
ССl3СООН → CHCl3↑ + СО2↑
Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании: t°
НООС-СН2-СООН → СН3СООН + CO2↑
28. Одноосновные кислоты этиленового ряда общей формулы СnН2n _ 2О2 обычно носят тривиальные названия. Первый гомолог СН2=СН—СООН называется акриловой кислотой.
Из высокомолекулярных кислот наиболее важной является олеиновая кислота C17H33COOH, по названию которой иногда весь гомологический ряд называют «рядом олеиновой кислоты» (но также «рядом акриловой кислоты»).
Положение двойной связи по отношению к карбоксильной группе обозначают буквами греческого алфавита, указывающими места атомов углерода, между которыми находится двойная связь. Так, акриловая кислота есть α,β-ненасыщенная кислота.
Акриловая кислота (пропеновая кислота, этенкарбоновая кислота) СН2=СН-СООН — простейший представитель одноосновных непредельных карбоновых кислот. Бесцветная жидкость с резким запахом, растворима в воде, диэтиловом эфире, этаноле, хлороформе. Легко полимеризуется с образованием полиакриловой кислоты. С другими мономерами образует сополимеры.
Сейчас применяют парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовых катализаторах.
СН2=СН–СН3 + O2 → СН2=СН–СООН
Раньше использовалась реакция взаимодействия ацетилена, оксида углерода (II) и воды:
СН≡СН + СО + Н2О → СН2=СН–СООН
или кетена с формальдегидом.
СН2=С=О + H2C=O → СН2=СН–СООН
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещенных производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
n-ClC6H4N2Cl + СН2=СНСООН n-ClC6Н4СН=СНСООН + HCl + N2.
При УФ-облучении или в кислых водных растворах (рН=1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([—СН2—СН(СООН)—]n).
Олеиновая кислота (цис-9-октадеценовая кислота) СН3(СН2)7СН=СН(СН2)7СООН — мононенасыщенная жирная кислота. Является наиболее распространенной в природе ненасыщенной жирной кислотой.
Бесцветная вязкая жидкость, tпл 13,4 °C (для нестабильной бета-модификации) и 16,3 °C (для стабильной альфа-модификации). tкип 286 °C
Окисляется перманганатом калия с расщеплением двойной связи, образуя смесь азелаиновой и пеларгоновой кислот, гидрируется до стеариновой кислоты.
Двойная связь в олеиновой кислоте имеет цис-конфигурацию, изомеризация в транс-изомер — элаидиновую кислоту — протекает под действием различных катализаторов (диоксид азота, алифатические нитрилы). Изомеризация олеиновой кислоты под действием азотистой кислоты в более высокоплавкую (температура плавления 44 °C) элаидиновую кислоту (элаидиновая проба) применяется для определения типа растительных масел: смесь кислот, полученная из невысыхающих масел, содержащих преимущественно эфиры олеиновой кислоты, под действием кислого раствора нитрита натрия при комнатной температуре застывает в плотную массу, смесь кислот, полученная при омылении невысыхающих масел, содержащих значительные количества полиненасыщенных кислот (линолевой и линоленовой) в условиях элаидиновой пробы остается жидкой.
Содержится во многих растительных и животных жирах в виде сложных эфиров — глицеридов, содержание олеиновой кислоты в оливковом масле — до 81 %, в арахисовом — до 66 %, в подсолнечном — до 40 %, в говяжьем жире 41-42 %, в свином — 37-44 %, в тресковом — 30 %.
Олеиновая кислота и ее эфиры применяют для получения лакокрасочных материалов, как пластификаторы. Применяется в мыловарении, а также широко применяется (в качестве СОЖ) при обработке резанием труднообрабатываемых высоколегированных (нержавеющих) сталей и сплавов. Применяется также для доводки уплотнительных поверхностей из коррозионных, нержавеющих сталей и твёрдых сплавов, съём металла до 22 мкм. (источник РД 24.023.53-90)Кроме того, используется в качестве стабилизатора магнитных жидкостей на основе углеводородных носителей ферромагнитных частиц.
Линолевая кислота — одноосновная карбоновая кислота с двумя изолированными двойными связями CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH.
Линолевая кислота — светло-жёлтая маслянистая жидкость, нерастворимая в воде, но хорошо растворимая во многих органических растворителях. Tпл −11 °C, tkип 182 °C (532 н/м², или 4 мм рт. ст.), плотность 0,903 г/см³ (20 °C). Содержание в растительных маслах и животных жирах (%): кокосового масла 1,5—2,6; касторового 2,0—3,0; кориандрового 7,0—7,5; горчичного 14,5—20,0; льняного 15,0—30,0; хлопкового 40,0—45,0; кукурузного 43,5—46,9; подсолнечного масла 46,0—60,0; соевого 52,0—65,0; конопляного 56,0—65,0; макового 58,0—65,0 %; говяжьего жира 2,0—5,0; бараньего 3,0—4,0; свиного 3,0—8,0. В натуральных жирах линолевая кислота находится в виде геометрического цис-изомера. Она имеет неразветвлённую цепь углеродных атомов и две изолированные двойные связи, одна из которых расположена между 9-м и 10-м, а вторая между 12-м и 13-м углеродными атомами (9,12-уноктадиеновая кислота). По положению двойной связи эта кислота относится к семейству кислот ω-6. Имея такое строение, линолевая кислота окисляется кислородом воздуха легче, чем олеиновая.
Линолевая кислота относится к классу омега-6-ненасыщенных жирных кислот, поэтому организм человека способен синтезировать из неё относящуюся к этому же классу четырежды ненасыщенную арахидоновую жирную кислоту
Линоленовая кислота — одноосновная карбоновая кислота с тремя изолированными двойными связями, CH3(CH2CH=CH)3(CH2)7COOH. CAS 463-40-1
Бесцветная маслообразная жидкость; tkип 184 °C (532 н/м², или 4 мм рт. ст.), плотность 0,906 г/см³ (20 °C).
29. Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN (от англ. nucleophile addition).
Присоединение циановодородной (синильной) кислоты HCN
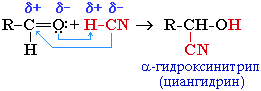
та реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O R-CH(COOH)OH + NH3
Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора):
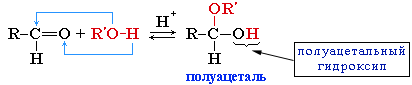
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:

Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами.
Присоединение реактива Гриньяра

30-31. ОКСИКИСЛОТЫ (гидроксикарбоновые к-ты, гидроксикис-лоты), содержат в молекуле карбоксильную и гидроксиль-ную группы.
Число групп СООН определяет основность оксикислот, а число групп ОН (включая ОН в СООН)-их атомность. Мн. природные оксикислоты содержат один или неск. асимметрич. атомов С и существуют в виде оптич. изомеров.
Оксикислоты- кристаллич. в-ва, низшие оксикислоты из-за сильной гигроскопичности - густые сиропообразные жидкости, хорошо раств. в воде. Физ. св-ва нек-рых оксикислот представлены в таблице. Оксикислоты вступают в р-ции, характерные для карбоновых к-т и спиртов, обладают также специфич. св-вами. Они более сильные к-ты, чем соответствующие карбоновые. Это объясняется существованием внутримол. водородной связи между группами ОН и СООН в и -оксикислотах; более сильную водородную связь образует карбоксилат-анион, получающийся при диссоциации оксикислот. Повышению кислотности способствует также индуктивный эффект группы ОН. -Оксикислоты при нагр. дегидратируются с образованием лактидов;-оксикислоты с третичной группой ОН при нагр. образуют кетоны и -непредельные к-ты, а при окислении (КМnО4, Н2СrO4 и др.)-кетоны, напр.:
Подобно тому, как существуют многоатомные спирты, существуют и оксикислоты с несколькими спиртовыми группами в молекуле. Если монооксикислоты можно рассматривать как продукты окисления гликолей по крайней мере с одной первичной спиртовой группой, полиоксикислоты можно рассматривать как продукты окисления многоатомных спиртов.
Действительно, при окислении глицерина азотной кислотой Н. Н. Соколов получил глицериновую или диоксипропионовую кислоту, в молекулах которой кроме карбоксильной группы содержатся первичная и вторичная спиртовые функциональные группировки СН2ОН—СНОН—СООН. При окислении спирток высшей атомности можно получить одноосновные кислоты с большим количеством спиртовых гидроксилов. Все оксикислоты с одной карбоксильной группой одноосновны. Общее количество содержащихся в их молекуле гидроксилов, включая и карбоксильный, называются их атомностью. На этом основании гликолевая и молочная кислоты одноосновны и двухатомны, а глицериновая одноосновна и трехатомна.
Простейшей одноосновной многоатомной оксикислотой является трехатомная α,β-диоксипропионовая кислота строения СН2(ОН)—СН(ОН)—СООН, называемая обыкновенно глицериновой, так как она получается окислением глицерина. Из оксикислот высшей атомности наибольший интерес представляют кислоты с нормальной цепью атомов углерода вследствие их близости к природным многоатомным спиртам, а также к простейшим углеводам, т. е. моносахаридам.
Одноосновные многоатомные оксикислоты именно этого рода получаются окислением многоатомных спиртов и моносахаридов, относящихся к группе альдоз. Получаемые таким образом одноосновные оксикислоты носят общее название оновых (или альдоновых). По числу атомов углерода их называют тетроновыми, пептоновыми, гексоновыми и т. д. Названия отдельных кислот этого рода, производятся от названий тех альдоз, окислением которых они могут быть получены, с прибавлением окончания «оновая кислота». Так, например, при окислении арабинозы СН2ОН—(СНОН)3—СНО получается арабоновая кислота СН2ОН—(СНОН)3—СООН; окислением стереоизомерных альдогексоз строения СН2ОН—(СНОН)4—СНО — глюкозы, маннозы и галактозы — получаются стереоизомерные гексоновые кислоты: глюконовая, манноновая, галактоновая. Строение этих гексоновых кислот выражается одной и той же формулой СН2ОН—(СНОН)4—СООН.
О. — весьма реакционноспособные соединения. Они, например, при нагревании легко отщепляют воду, при этом в зависимости от строения О. образуются различные продукты: a-О. дают лактиды (циклические сложные эфиры), b-О. — непредельные кислоты, g- и d-О. — внутренние эфиры (лактоны; см., например, Пропиолактон). О. могут быть получены окислением гликолей, содержащих хотя бы одну первичную группу –ОН, омылением оксинитрилов, действием азотистой кислоты на аминокислоты и др. методами
32. Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают C-нитросоединения, в которых нитрогруппа связана с атомом углерода. O-нитросоединения и N-нитросоединения выделяют в отдельные классы — нитроэфиры (органические нитраты) и нитрамины
В зависимости от радикала R, различают алифатические (предельные и непредельные), ациклические, ароматические и гетероциклические нитросоединения. По характеру углеродного атома, с которым связана нитрогруппа, нитросоединения подразделяются на первичные, вторичные и третичные.
Нитросоединения изомерны эфирам азотистой кислоты HNO2 (R-ONO)
При наличии α-атомов водорода (в случае первичных и вторичных алифатических нитросоединений) возможна таутомерия между нитросоединениями и нитроновыми кислотами (аци-формами нитросоединений):
Получение
Из галогенпроизводных:
![]()
Нитрование
Реакция Коновалова(для алифатических углеводородов)
Нитрование ароматических углеводородов.
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
Восстановление нитросоединений (Реакция Зинина):
![]()
Реакции конденсации
Таутомерия нитросоединений.
