
- •Производные углеводородов и простейших гетероциклических соединений
- •7. Полимеры получают с помощью реакций двух основных типов — полимеризации и поликонденсации.
- •17. Галогенопроизводные углеводородов
- •21. Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
- •1. Действие водоотнимающих средств
- •2. Действие галоидных алкилов на алкоголяты.
- •6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
1. Действие водоотнимающих средств
Классическим способом получения простых эфиров является действие на спирты серной кислоты. При этом, например, из этилового спирта сначала получается этилсерная, или серновинная, кислота (Вильямсон)
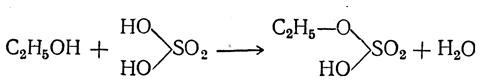
которая при нагревании с избытком спирта образует простой эфир, причем выделяется молекула серной кислоты:
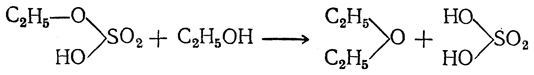
Таким образом, серная кислота в конце процесса оказывается неизмененной и может снова войти в реакцию со спиртом, т. е. она играет роль катализатора.
Во второй фазе реакции можно взять другой спирт. Тогда получается смешанный эфир:
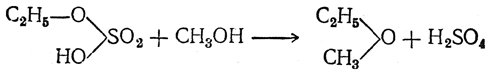
Так как образующаяся при реакции вода может отгоняться с эфиром (вместе с небольшим количеством спирта), то теоретически было бы достаточно небольшого количества серной кислоты, чтобы превратить в эфир неограниченные количества спирта. Однако наряду с образованием эфира идет также и окисление спирта серной кислотой с восстановлением последней до сернистого ангидрида. Поэтому на заводах, где процесс ведется непрерывно, серную кислоту приходится периодически добавлять. Добавка к серной кислоте некоторых сернокислых солей (например, сернокислого алюминия) благоприятствует образованию эфира. Диэтиловый эфир образуется также при водоотнимающем действии некоторых других кислот (фосфорная кислота, органические сульфокислоты и пр.) и некоторых безводных солей (хлористый цинк, сернокислая медь и пр.). Было предложено получать его сухим путем, пропуская пары спирта через нагретые до 150—200° С обезвоженные квасцы.
Простые эфиры образуются также как промежуточные продукты при получении олефинов пропусканием паров спирта над глиноземом, окисью тория и т. п.
2. Действие галоидных алкилов на алкоголяты.
Второй способ получения простых эфиров состоит в действии галоидных алкилов на алкоголяты (Вильямсон). И в этом случае можно получать как симметричные простые эфиры, так и смешанные:
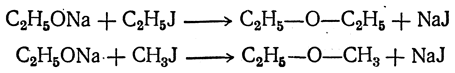
При этом наряду с эфирами, а иногда почти исключительно, образуются этиленовые углеводороды.
Простые эфиры, получаемые из низших спиртов, кипят при более низкой температуре, чем соответствующие спирты. Диметиловый эфир и метилэтиловый эфир при обыкновенной температуре — газы. Первый имеет т. кип. —23,7° С, а второй +10,8° С. Даже низшие эфиры не смешиваются с водой, но несколько в ней растворяются и сами ее несколько растворяют.
Простые эфиры — нейтральные вещества. Они довольно трудно вступают в реакции, но с концентрированной и особенно с дымящей серной кислотой реагируют с образованием сложных эфиров серной кислоты — кислых и средних.
Соответственно строению простых эфиров, атомы водорода в них не могут заменяться на металл, но довольно легко замещаются на атомы хлора. Иодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и иодистый алкил:
![]()
Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров за счет окисления в α-положении к эфирному кислороду, например:
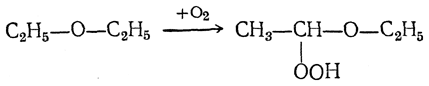
Эти вещества чрезвычайно взрывчаты и являлись причиной сильных взрывов в лабораториях. Взрывы происходили в конце перегонки эфира, не очищенного предварительно от перекисей.
Натрий при низких температурах не действует на простые эфиры. При более высоких температурах простые эфиры (особенно их высшие гомологи) расщепляются по уравнению
R—О—R + 2Na→ R—ONa + R—Na
Еще легче реагирует калий и особенно легко — литий. Как показал П. П. Шорыгин, образующиеся металлоорганические соединения легко подвергаются дальнейшим превращениям.
23. Органические соединения, в молекуле которых имеется карбонильная группа > С=О, называются карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы — альдегиды и квтоны. В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом а в молекулах кетонов — с двумя углеводородными радикалами.
Углеводородные радикалы могут быть алифатическими (насыщенными или ненасыщенными), алициклическими и ароматическими.
В молекуле кетона радикалы могут быть одинаковыми или разными. Поэтому кетоны, как и простые эфиры, делятся на симметричные и смешанные.
Мы рассмотрим только алифатические карбонильные соединения. Общая формула предельных альдегидов и кетонов СnН2nО.
Строение. В карбонильной группе связь между атомами углерода и кислорода — двойная. Атом углерода находится в состоянии sp2-гибридизации и образует 3 σ-связи (две связи С-Н и одну связь С-О), которые располагаются в одной плоскости под углом 120° друг к другу, p-связь С-О образована при перекрывании негибридных 2р-орбиталей атомов углерода и кислорода. Двойная связь С=О является сочетанием одной s- и одной p-связей. В силу большей электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода:
Полярность связи С=О сказывается на физических и химических свойствах карбонильных соединений. Изомерия альдегидов связана только со строением углеродного скелета, например:
СН3-СН2-СН2-СН=О СН3-СН(СН3)-СН=О.
Изомерия кетонов связана со строением углеродного скелета и с положением карбонильной группы, например:

Кроме того, альдегиды и кетоны с одинаковым числом атомов углерода изомерны друг другу, например ацетон и пропаналь или глюкоза и фруктоза.
Номенклатура. Для альдегидов часто используют тривиальные названия, например формальдегид Н2С=О. По международной номенклатуре названия альдегидов образуют, прибавляя окончание -аль к названию углеводорода с самой длинной углеродной цепью, включающей карбонильную группу, от которой и начинают нумерацию цепи.
Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой, например метилэтилкетон СН3-СО-СН2-СН3. По международной номенклатуре: к названию предельного углеводорода добавляют окончание -он и указывают номер атома углерода, связанного с карбонильным кислородом. Нумерацию начинают с ближайшего к карбонильной группе конца цепи, например: метилэтилкетон — это то же самое, что бутанон-2.
Физические свойства. Карбонильные соединения не образуют водородных связей, поскольку в их молекулах нет атомом водорода с положительным зарядом. По этой причине температуры кипения альдегидов и кетонов значительно ниже, чем соответствующих спиртов. Низшие альдегиды и кетоны —легкокипящие жидкости (формальдегид — газ) с резким запахом, хорошо растворимы в воде.
Получение.
1. Гидратация алкинов. Из ацетилена получается альдегид, из его гомологов — кетоны :
Hg2+, H+
СH≡СН + Н2О → СН3-СН=О.
Hg2+, H+
СН3-С≡СН + Н2О → СН3-СО-СН3.
Из-за своей относительной дороговизны, а также из-за того, что получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение.
2. Общий способ получения карбонильных соединений окисление спиртов . В качестве окислителя можно использовать не только дихромат или перманганат калия, но и другие окислители, например, оксид меди (II) при нагревании:
t
СН3-СН2-ОН + СuО → СН3-СН=О + Сu + Н2О,
t
СН3-СН(ОН)-СН3 + СuО → СН3-СО-СН3 + Сu + Н2О.
3. При щелочном гидролизе дигалогеналканов, содержащих два атома галогена при одном атоме углерода, образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и отщепляют воду, превращаясь в карбонильные соединения:
2NaOH
СН3-СНСl2 → [СН3СН(ОН)2] → СН3-СН=О + Н2О.
-2NaCl
4. Дегидрирование спиртов. Одним из промышленных способов получения альдегидов и кетонов является дегидрированиеспиртов в газовой фазе над металлическими медью, серебром, хромом, никелем, оксидом цинка и др., например:
ZnO, 380° С
СН3-СН(ОН)-СН3 → СН3-СО-СН3
Пропанол-2 Ацетон (выход-90%)
5. Окисление алкенов. Альдегиды и кетоны получают окислением углеводородов ряда этилена кислородом воздуха в присутствии хлоридов палладия (II) и меди (I), например:
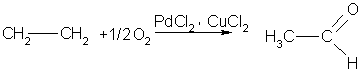
Этим экономичным способом в промышленности получают низшие альдегиды и кетоны.
6. Простейший кетон — ацетон — получают кумольным методом вместе с фенолом.
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью. Альдегиды и кетоны — химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму нуклеофильного присоединения (обозначается AN от англ, addition nucleophilic). Активность альдегидов и кетонов в реакциях присоединения определяется величиной положительного заряда d+ на атоме углерода в карбонильной группе. Электронодонорные группы, связанные с группой СО, уменьшают величину этого заряда. Карбонильная группа кетонов связана с двумя углеводородными радикалами (которые являются электронодонорными группами), поэтому кетоны менее активны, чем альдегиды (в которых группа СО связана только с одним радикалом). Самым активным из альдегидов является формальдегид H2CO.
24. Важнейшие реакции присоединения:
1. Присоединение водорода (восстановление). При взаимодействии альдегидов с водородом получаются первичные спирты:
Ni, t
R-CH=O + Н2 → R-CH2-OH.
Кетоны в аналогичной реакции дают вторичные спирты. В лабораторных условиях для восстановления карбонильных соединений используют алюмогидрид лития LiAlH4.
2. Присоединение циановодородной (синильной) кислоты:
KCN
СН3-СН=О + H-CN → СН3-СН(СN)-ОН.
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используются для удлинения углеродной цепи.
3. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
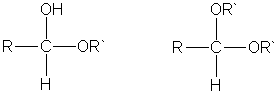
4. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень
легко гидролизуется:
R-CH=O + NaHSO3 → R-CH(OH)-SO3Na.
5. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
R-X + Mg → R-Mg-X ,
где R — алкильный или арильный радикал, X — галоген.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра
гидролизуют водой:
Н2O
Н2СО + RMgX → R-CH2-O-MgX → R-CH2-OH .
-Mg(OH)X
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:

в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
Н2O
(СН3)2С=O + R-MgX → (СН3)2С( R)-O-MgX → (СН3)2С( R)-OH
-Mg(OH)X
