
- •Производные углеводородов и простейших гетероциклических соединений
- •7. Полимеры получают с помощью реакций двух основных типов — полимеризации и поликонденсации.
- •17. Галогенопроизводные углеводородов
- •21. Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
- •1. Действие водоотнимающих средств
- •2. Действие галоидных алкилов на алкоголяты.
- •6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
17. Галогенопроизводные углеводородов
Производные углеводородов, содержащие вместо одного или нескольких атомов водорода галогены называются галогенопроизводными. В зависимости от характера углеводорода, в молекулу которого введен галоген, их делят на галогеналкилы жирного ряда и ароматические галогенопроизводные галогенарены.
Номенклатура, изомерия
По рациональной номенклатуре название галогенопроизводных образуют из названия углеводородного радикала и галогена, в необходимых случаях указывают положение последнего.
По систематической номенклатуре положение атома галогена указывают цифрой, которая вместе с его названием располагается перед названием радикала. Нумерацию атомов углерода начинают с того конца молекулы, к которому ближе расположен атом галогена.
Способы получения галогенопроизводных
Замещение атомов водорода в алканах на галоген
Реакции протекают только при повышенных температурах или облучении УФ-светом по гомолитическому радикальному механизму. Замещение происходит у третичного атома углерода.
Замещение атомов водорода в бензоле
Бензол и его гомологи хлорируются легче, чем алканы, механизм реакции – электрофильное замещение.
Получение галогенопроизводных из спиртов
При взаимодействии спиртов с галогеноводородами применяют водоотнимающие средств хлорид кальция.
При действии на спирты галогенидов фосфора или серы происходит реакция замещения гидроксильной группы на галоген.
Физические свойства
Галогенуглеводороды имеют в своей структуре полярные ковалентные связи, поэтому обладают заметным дипольным моментом. Для этих соединений характерно слабое межмолекулярное взаимодействие, характерны низкие температуры кипения и плавления. Галогенуглеводороды практически нерастворимы в воде, но растворимы в органических растворителях, они растворяют жиры и масла.
Химические свойства
Химические свойства алкилгалогенидов обусловлены разрывом связей С — Галоген.
Наиболее легко реакции замещения протекают для иодпроизводных. Механизм процесса — нуклеофильное замещение SN.
По современным представлениям реакции нуклеофильного замещения могут протекать по двум механизмам: мономолекулярному SN1 и бимолекулярному SN2.
Механизм SN2
Этот механизм характерен для первичных алкилгалогенидов.
Реакция замещения происходит в результате постепенного вытеснения старой группы новой группой. Образование новой и разрыв старой связи происходит одновременно.
В переходном состоянии центральный атом гибридизован, как в алкенах, все его связи находятся в одной плоскости, а входящая и уходящая группы находятся за и перед плоскостью молекулы. Нуклеофильная атака осуществляется с тыла.
Механизм SN1
Мономолекулярный механизм характерен для первичных алкилгалогенидов и галогенидов аллильного и бензильного типа.
При мономолекулярном механизме сначала происходит ионизация связи углерод — галоген, а затем нуклеофил быстро взаимодействует с карбкатионом.
Первая стадия определяет скорость процесса в целом, на этой стадии происходит медленная диссоциация бромистого трет.бутила, поэтому скорость реакции не зависит от концентрации нуклеофила.
Соединения с вторичными радикалами могут реагировать по двум механизмам.
Подвижность галогенов
Если атом галогена находится у ненасыщенного углеродного атома или связан с атомом углерода бензольного ядра, подвижность галогена резко снижается:
В молекулах хлорбензола и винилхлорида наблюдается сопряжение между свободными электронами атома галогена и ? — электронами двойной связи или бензольного кольца, что снижает подвижность галогенов.
Галогениды аллильного и винильного типа
Аллилгалогениды имеют подвижный атом галогена. Как видно и представленной формулы, в этой молекуле ? — электроны двойной связи не находятся в сопряжении с р — электронами галогена.
Реакции отщепления элиминирования
Химические свойства арилгалогенидов
Реакции электрофильного замещения были рассмотрены в разделе «Арены». Незамещенные и замещенные арилгалогениды с электронодонорными
18. Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCH2-OH), вторичные (R2CH-OH) и третичные (R3С-ОН).
Изомерия одноатомных спиртов связана со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2) и с положением группы ОН (пропанол-1 и пропанол-2).
Номенклатура.
Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена заместительная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: C2H5OH — этиловый спирт.
Физические свойства. Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей .
Получение.
1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором:
H3PO4
СН2=СН2 + Н2О → СН3—СН2—ОН.
Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.
2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr.
По этой реакции можно получать первичные, вторичные и третичные спирты.
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:
R—CH=O + Н2 → R—CH2—OH, (1)
R—CO—R' + Н2 → R—CH(OH) —R'. (2)
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
4. Действие реактивов Гриньяра на карбонильные соединения .
5. Этанол получают при спиртовом брожении глюкозы:
С6Н12О6 → 2С2Н5ОН + 2СО2↑.
19. Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН. Связи С-О и О-Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
1) Реакции с разрывом связи О-Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
2) Реакции сопровождающиеся разрывом связи С-О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация): б) замещение группы -ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С-О, уменьшается в ряду: третичные спирты > вторичные > первичные.
Спирты являются амфотерными соединениями.
Реакции с разрывом связи О-Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
2С2Н5-ОН + 2K→ 2С2Н5-ОK + Н2↑, (3)
но не реагируют с щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов:
С2Н5ОK + Н2О → С2Н5ОН + KОН.
Это доказывает, что спирты — более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления :
Н+
С2Н5ОН + СН3СООН СН3СООС2Н5 + Н2О
Этилацетат
C2H5OH + HONO2 C2H5ONO2 + Н2O
Этилнитрат
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН - от кислоты. (Установлено экспериментально методом "меченых атомов" ).
3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
[O] [О]
R-CH2-OH → R-CH=O → R-COOH.
Вторичные спирты окисляются в кетоны:
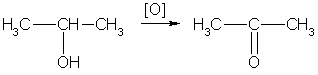
Третичные спирты могут окисляться только с разрывом С-С связей.
Реакции с разрывом связи С-О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
H2SO4 ,t >150°С
СН3-СН2-СН2-ОН → СН3-СН=СН2 + Н2О.
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
H2SO4,t< 150°С
2CH3-CH2-OH → C2H5-O-C2H5 + H2O.
2) Спирты обратимо реагируют с галогеноводородными кислотами (здесь проявляются слабые основные свойства спиртов):
ROH + HCl RCl + Н2О
Третичные спирты реагируют быстро, вторичные и первичные - медленно.
Применение. Спирты главным образом используют в промышленности органического синтеза. Этанол - важное сырье пищевой промышленности.
20. Важнейшие из многоатомных спиртов - этиленгликоль и глицерин
Это — вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение.
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):
ClCH2-CH2Cl + 2NaOH → НОСН2-СН2ОН + 2NaCl.
2. Этиленгликоль образуется при окислении этилена водным раствором перманганата калия:
СН2=СН2 + [О] + Н2О → НOСН2-СН2ОН.
3. Глицерин получают гидролизом жиров.
Химические свойства. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко, синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди:
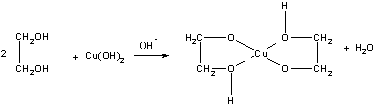
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2 непосредственно связана с атомом углерода):

Применение. Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах он используется также для получения диоксана, важного (хотя и токсичного) лабораторного растворителя. Диоксан получают межмолекулярной дегидратацией этиленгликоля:
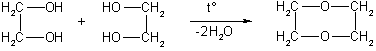
Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
