
- •Производные углеводородов и простейших гетероциклических соединений
- •7. Полимеры получают с помощью реакций двух основных типов — полимеризации и поликонденсации.
- •17. Галогенопроизводные углеводородов
- •21. Фенолами называют производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
- •1. Действие водоотнимающих средств
- •2. Действие галоидных алкилов на алкоголяты.
- •6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
1. Предметом органической химии считается химия соединений углерода с другими элементами. Однако, это не совсем верное определение, так как в предмет органической химии не входят такие соединения, как сам углерод, карбиды, оксиды углерода, карбонилы металлов, синильная и роданистоводородная кислота и их соли. В понятие органическая химия включают следующее:
Выделение чистых соединений из природного сырья различного происхождения.
Синтез и очистка соединений
Определение структуры природных или синтетически полученных веществ
Определение механизмов реакций и выявление связи между структурой и реакционной способностью.
Первые органические вещества, с которыми познакомился человек, были выведены из продуктов животного и растительного происхождения и продуктов их распада. Они являются важнейшими, но не единственными источниками органических соединений. В организме животных и растений протекают множество реакций приводящих к синтезу простых и сложных органических соединений. Первоисточником органических соединений все же следует считать растения, которые способны синтезировать их из неорганических под действием солнечных лучей. Животные организмы, хоть и способны к синтезу сложных органических соединений, все же в качестве исходных материалов для синтеза используют органические соединения, полученные в процессе питания и пищеварения. Древесные растения особо ценятся в качестве источника органических соединений. Помимо того, что они содержат в себе целлюлозу – исходный материал синтеза искусственных волокон, этилового спирта, пороха, пластмасс и др., под действием нагрева без доступа кислорода воздуха (сухой перегонке) из них можно получить еще массу органических соединений, в зависимости от условий сухой перегонки. В природе самопроизвольно совершаются медленные процессы, аналогичные как сгоранию органических веществ, полному или неполному, так и сухой перегонке. На поверхности земли при достаточном доступе воздуха остатки растений или животных подвергаются обычно сложным процессам гниения или тления под действием микроорганизмов. Если такое гниение происходит без доступа кислорода, происходит процесс, схожий с сухой перегонкой. В результате могут образовываться торф, каменный уголь, каменноугольная смола, природный газ и нефть (хоть его животно-растительное происхождение не до конца доказано). Все они и являются основными сырьевыми источниками органических веществ. Также многие органические вещества могут быть получены синтетическим путем.
2. Основная идея теории А. М. Бутлерова сформулирована им в 1861 г. в статье «О химическом строении веществ». А. М. Бутлеров выступил против положения теории типов о невозможности установления строения молекул химическим путем; он показал, что в молекуле имеется определенная последовательность химической связи атомов (химическое строение). Далее Бутлеров доказал, что строение молекулы можно установить, исследуя химические свойства вещества, и, наоборот, зная строение, можно предвидеть многие свойства соединения. Бутлеров не только обосновал это положение уже имевшимся фактическим материалом, но и предсказал на его основе возможность существования новых веществ, которые впоследствии были открыты им и другими химиками.
Основные положения теории химического строения А.М. Бутлерова
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Основой теории Бутлерова является идея о порядке химического взаимодействия атомов в молекуле. Этот порядок химического взаимодействия не включает представления о механизме химической связи и физическом расположении атомов. Эта важная особенность теории химического строения позволяет всегда опираться на нее при построении физической модели молекулы.
После создания теории химического строения, согласно которой природа вещества определяется не только характером и числом атомов, входящих в состав молекулы, но и ее структурой, химическим строением, стало возможным объяснить существование изомеров - веществ, имеющих одинаковый состав и молекулярный вес и, тем не менее, совершенно различных вследствие неодинакового химического строения.
Следует отметить, что А. М. Бутлеров открыл и впервые объяснил также явление динамической изомерии, заключающееся в том, что два или несколько изомеров в определенных условиях легко переходят друг в друга (явление это в настоящее время носит название таутомерия). Проблема изомерии в целом явилась серьезным испытанием для бутлеровской теории и была ею блестяще решена.
3. Современная классификация органических веществ основана на теории химического строения. Классом органических соединений, положенным в основу классификации, принято считать углеводороды: все остальные соединения рассматриваются как производные углеводородов, т. е. как вещества, происшедшие в результате замещений в углеводородах одного или нескольких атомов водорода на различные другие атомы или радикалы.
Современному состоянию органической химии наиболее соответствует разделение органических веществ на следующие большие группы:
Ациклические соединения, иначе называемые соединениями жирного ряда или алифатическими соединениями. Сюда относятся все углеводороды и их производные, не содержащие в молекулах колец, или циклов, а только так называемые «открытые цепи» углеродных атомов. Название «жирный ряд» является устарелым, хотя все еще очень употребительным, и произошло от того, что к этому классу соединений относятся природные жиры. Ациклические соединения разделяются на производные углеводородов гомологического ряда метана, общей формулы CnH2n+2, и на соединения других гомологических рядов, изологичных данному, т. е. содержащих в молекулах кратные (двойные или тройные) связи атомов углерода.
Изоциклические соединения, называемые также карбо-циклическими соединениями, содержат в молекуле кольца (циклы) из углеродных атомов. Обыкновенно эту группу соединений делят на два ряда.
А. Ряд алициклическкх соединений, куда относят все изоциклические соединения, за исключением бензола и его производных.
В ряду алициклических соединений различают:
1) насыщенные алициклические соединения, или циклопарафины, и их производные;
2) ненасыщенные алициклические соединения, содержащие в цикле или в боковой цепи двойные или тройные углерод-углеродные связи.
Б. Ряд ароматических соединений, выделяемый ввиду определенных химических особенностей относящихся к нему веществ. Для соединений этого ряда характерно присутствие в молекуле циклической группировки из шести атомов углерода, находящихся во втором валентном состоянии. Наиболее простым из ароматических соединений является углеводород формулы С6Н6, который называется бензолом. Все ароматические соединения бензольного ряда содержат ту же кольчатую группировку, которая содержится в бензоле. Эта группировка и называется бензольным, или ароматическим, ядром. Существуют также небензольные ароматические соединения, примерами которых могут служить тропон, трополон, азулен;
Гетероциклические соединения. К этой группе относятся соединения, содержащие в молекуле гетероциклические кольца, т. е. кольца, составленные не только из атомов углерода, но включающие также атомы каких-либо других элементов (гетеро-атомы, от греческого слова гетерос—иной). Чаще всего в образовании гетероциклических колец участвуют, кроме атомов углерода, атомы азота, серы и кислорода.
Производные углеводородов и простейших гетероциклических соединений
От основных веществ каждого ряда, т. е. от углеводородов и простейших гетероциклических соединений, могут быть выведены различные классы производных, характеризующиеся теми атомами или радикалами, которые замещают в основных веществах атомы водорода.
Наличие в молекуле тех или иных атомов и радикалов (кроме углеводородных) определяет целый ряд типических свойств соединений этих классов.
Из важнейших классов производных углеводородов укажем здесь следующие:
1. Галоидные производные, которые можно представить как углеводороды, в которых один или несколько атомов водорода замещены на атомы галоида. Соответственно этому различают фтористые, хлористые, бромистые и йодистые органические соединения.
2. Спирты (алкоголи), содержат в молекуле гид-роксильную группу —О—Н, связанную с углеводородным радикалом.
3. Простые эфиры содержат кислород, связанный с двумя углеводородными радикалами.
4. Альдегиды и кетоны содержат в молекуле двухатомную группу >С=О, называемую карбонильной группой или радикалом карбонилом. В альдегидах карбонил соединен с атомом водорода и с углеводородным радикалом, так что получается одноатомная группа называемая альдегидной группой. В кетонах карбонил соединен с двумя углеродными радикалами.
5. Органические (карбоновые) кислоты содержат в молекуле карбоксильную группу (радикал карбоксил), представляющую собой сочетание карбонильной и гидроксильной групп.
6. Производные, содержащие серу. Из этого класса можно отметить:
а) тиоспирты, или меркаптаны, содержащие группы —S—Н;
б) тиоэфиры общей формулы R—S—R (где R — углеводородный радикал);
з) сульфокислоты, содержащие одноатомный радикал сульфоксил —SO2—ОН.
7. Производные, содержащие в функциональной группе один атом азота. Важнейшие из них:
а) первичные, вторичные и третичные амины, содержащие радикалы —NH2 (аминогруппа), >NH (иминогруппа) и ≡N (нитрилогруппа). В аминах атомы азота соединены соответственно с одним, двумя и тремя атомами углерода;
б) нитрилы, или цианистые соединения, содержащие одноатомный радикал циан —C≡N.
8. Производные, содержащие в функциональной группе атом азота, связанный с кислородом. Наиболее важные из них:
а) нитросоединения, содержащие радикал —NO2 (нитрогруппа);
б) нитрозосоединения, содержащие группу —N = О (иитрозогруггпа).
9. Фосфины, арсины, стибины и виемутины представляют собой соединения, построенные аналогично аминам. Могут существовать соединения, содержащие группы —РН2, >РН и >Р— (первичные, вторичные и третичные фосфины). Так же построены арсины, содержащие остатки молекулы AsHa, стибины, содержащие остатки молекулы SbH3, висмутины, содержащие остатки молекулы BiH3.
10. Соединения, содержащие два связанных между собой атома азота. Сюда относится несколько важных классов органических соединений:
а) органические гидразины, содержащие несимметричные остатки молекулы гидразина NH2—NH2, а именно, остатки —NH—NH2 или >N—NH2 (если этот остаток соединен с двумя углеводородными радикалами). Соединения, в которых группа = N—NH2 связана с одним углеводородным радикалом, называются гидразонами; соединения, в которых группа — N—N— связана с двумя двухвалентными углеводородными радикалами, называются азинами;
б) гидразосоединения, содержащие симметричные остатки —NH—NH— или >N—N<;
в) азосоединения, содержащие радикал —N=N— (азогруппа), связанный с двумя углеводородными радикалами; их строение выражается формулой R—N =N—R;
г) диазосоединения, в которых азогруппа —N=N— одновременно связана с одним углеводородным остатком с одной стороны и с неуглеродным атомом — с другой, например, как в соединении С6Н5—N=N—SO3Na.
11. Металлоорганические соединения, содержащие атомы металла, непосредственно связанные с атомами углерода. Различают «полные» металлоарганические соедине ния, в которых атом металла связан только с углеводородными радикалами, и «смешанные» металлоорганические соединения, где атом металла связан еще также с неуглеродным атомом.
12. Многоатомные соединения. Соединения, производимые от углеводородов замещением в них двух или более атомов водорода на одинаковые или различные атомы или радикалы (кроме углеводородных), называются многоатомными соединениями.
Многоатомные соединения, содержащие одновременно два или более различных атомов или радикалов (помимо углеводородного остатка), называются соединениями со смешанными функциями. Эти классы соединений обыкновенно получают название, отвечающее содержащимся в них различным функциональным группам; например, при наличии в молекуле гидроксильной группы ОН и альдегидной группы СНО вещества называются альдегидоспиртами, или оксиальдегидами, при наличии в молекуле гидроксильной группы ОН и карбоксильной группы СООН — оксикислотами, NH2 и ОН — аминоспиртами, NH2 и СООН — аминокислотами и т. д.

4. Реакции нуклеофильного присоединения (англ. addition nucleophilic reaction) — реакции присоединения, в которых атаку на начальной стадии осуществляет нуклеофил — частица, заряженная отрицательно или имеющая свободную электронную пару. На конечной стадии образующийся карбанион подвергается электрофильной атаке.
Механизм реакций нуклеофильного присоединения по связи углерод-углерод
Нуклеофильное присоединение по кратной связи обычно двухстадийный процесс AdN2 — реакция бимолекулярного нуклеофильного присоединения
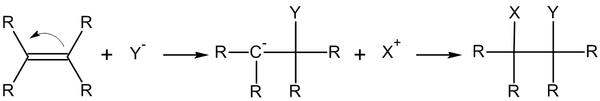
Механизм реакций нуклеофильного присоединения по связи углерод-гетероатом
Электрофильное присоединение по кратной связи углерод-гетероатом имеет механизм AdN2:
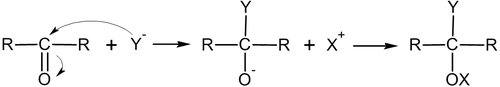
Реакции электрофильного присоединения (англ. addition electrophilic reaction) — реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил — частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся карбкатион подвергается нуклеофильной атаке.
В органической химии чаще всего атакующей электрофильной частицей является протон H+
Реакции радикального присоединения (англ. addition radical reaction) — реакции присоединения, в которых атаку осуществляют свободные радикалы — частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и нейтральные частицы.
Реакции радикального присоединения обозначают AdR.
Реакции свободнорадикального присоединения характерны для алкенов, которые часто вступают в них вместо реакций электрофильного присоединения в присутствии источника свободных радикалов.
1. Первая стадия — инициирование цепи. Она может начаться спонтанно, фотохимически, электрохимически, посредством нагревания или путем химического иницирования[2].
2. Вторая стадия — развитие цепи. На этой стадии радикалы реагируют с молекулами, образуя продукты реакции и новые радикалы.
3. Третья стадия — обрыв цепи или рекомбинация свободных радикалов.
Радикальное присоединение идет против правила Марковникова (эффект Хараша). Вызвано это повышенной стабильностью третичных, аллильных и некоторых других радикалов, образующихся при присоединении атакующего радикала в определённую позицию в молекуле.
5. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (полимеры), характеризуются мол. массой от неск. тысяч до неск. (иногда многих) миллионов. В состав молекул высокомолекулярных соединений (макромолекул) входят тысячи атомов, соединенных хим. связями. Любые атом или группа атомов, входящие в состав цепи полимера или олигомера, наз. составным звеном. Составное звено, к-рое образуется из одной молекулы мономера при полимеризации, наз. мономерным звеном (ранее иногда наз. элементарным звеном).
Название линейного полимера образуют прибавлением приставки "поли" (в случае неорганич. полимеров -"катена-поли"): а) к названию составного повторяющегося звена, заключенному в скобки (систематич. названия); б) к названию мономера, из к-рого получен полимер
По происхождению полимеры делят на:
1. Природные, биополимеры (полисахариды, белки, нуклеиновые кислоты, каучук, гуттаперча).
2. Химические:
ü Искусственные – полученные из природных путем химических превращений (целлулоид, ацетатное, медноамиачное, вискозное волокна).
1. Синтетические – полученные из мономеров (синтетические каучуки, волокна /капрон, лавсан/, пластмассы).
По составу:
1. Органические.
2. Элементоорганические – делятся на три группы: основная цепь неорганическая, а ответвления органические; основная цепь содержит углерод и другие элементы, а ответвления органические; основная цепь органическая, а ответвления неорганические.
3. Неорганические – имеют главные неорганические цепи и не содержат органических боковых ответвлений (элементы верхних рядов III – VI групп).
По структуре макромолекулы:
1. Линейные (высокоэластичные).
2. Разветвленные.
3. Сетчатые (низкоэластичные).
По химическому составу:
1. Гомополимеры (содержат одинаковые мономерные звенья).
2. Гетерополимеры или сополимеры (содержат разные мономерные звенья)
По составу главной цепи:
1. Гомоцепные (в главную цепь входят атомы одного элемента).
2. Гетероцепные (в главную цепь входят разные атомы)
По пространственному строению:
1. Стереорегулярные – макромолекулы построены из звеньев одинаковой или разной пространственной конфигурации, чередующихся в цепи с определенной периодичностью.
2. Нестереорегулярные (атактические) – с произвольным чередованием звеньев разной пространственной конфигурацией.
По физическим свойствам:
1. Кристаллические (имеют длинные стереорегулярные макромолекулы)
2. Аморфные
По способу получения:
1. Полимеризационные.
2. Поликонденсационные.
По свойствам и применению:
1. Пластмассы.
2. Эластомеры.
3. Волокна.
6. Общие свойства полимеров (характерные для большинства ВМС).
1. ВМС не имеют определенной температуры плавления, плавятся в широком диапазоне температур, некоторые разлагаются ниже температуры плавления.
2. Не подвергаются перегонке, т. к. разлагаются при нагревании.
3. Не растворяются в воде или растворяются с трудом.
4. Обладают высокой прочностью.
5. Инертны в химических средах, устойчивы к воздействию окружающей среды.
Получение полимеров.
К образованию ВМС приводят три процесса:
1) Реакция полимеризации – процесс, в результате которого молекулы низкомолекулярного соединения (мономеры) соединяются друг с другом при помощи ковалентных связей, образуя полимер. Эта реакция характерна для соединений с кратными связями.
2) Реакция поликонденсации – процесс образования полимера из низкомолекулярных соединений, содержащих 2 или несколько функциональных групп, сопровождающийся выделением за счет этих групп, таких веществ, как вода, аммиак, галогеноводород и т. п. (Капрон, нейлон, фенолформальдегидные смолы).
3) Реакция сополимеризации – процесс образования полимеров из двух или нескольких разных мономеров. (Получение бутадиенстирольного каучука).
Теперь рассмотрим полимеры, совмещая два признака: по происхождению – природные и химические, и по свойствам и применению – белки, полисахариды, нуклеиновые кислоты, пластмассы, эластомеры, волокна.
Св-ва отдельных высокомолекулярные соединения определяются хим. составом, строением, конформацией и взаимным расположением макромолекул (надмолекулярной структурой). В зависимости от этих факторов св-ва высокомолекулярных соединений могут изменяться в широких пределах.
Высокомолекулярные соединения могут вступать в следующие р-ции:
1) соединение макромолекул поперечными хим. связями (т. наз. сшивание), происходящее, напр., при вулканизации каучуков, отверждетш реактопластов, дублении кож;
2) распад молекулярных цепей на более короткие фрагменты
3) р-ции макромолекул с низкомол. соединениями, при к-рых изменяется природа боковых функц. групп, но сохраняются длина и строение скелета осн. цепи (т. наз. полимераналогичные превращения), напр. омыление поливинилацетата с образованием поливинилового спирта;
4) внутримолекулярные р-ции между функц. группами одной макромолекулы, напр. внутримолекулярная циклизация.
Гетероцепные высокомолекулярные соединения в отличие от карбоцепных обычно относительно легко гидролизуются.
Нек-рые св-ва высокомолекулярных соединений, напр. р-римость, способность к вязкому течению, стабильность, существенно зависят от небольших кол-в примесей или добавок, реагирующих с макромолекулами. Так, чтобы превратить линейный полимер из р-римого в полностью нерастворимый, достаточно одной-двух поперечных связей на одну макромолекулу.
Получение. Прир. высокомолекулярные соединения, образующиеся в клетках живых организмов в результате биосинтеза, м. б. выделены из растит. и животного сырья с помощью экстрагирования, фракционного осаждения и др. методов. Основные пути получения синтетических высокомолекулярных соединений - полимеризация и поликонденсация.
Карбоцепные высокомолекулярные соединения обычно синтезируют полимеризацией мономеров по кратным углерод-углеродным связям. Гетероцепные высокомолекулярные соединения получают поликонденсацией, а также полимеризацией мономеров по кратным гетероатомным связям типа С=О, N=C—О, СN (напр., альдегиды, изоцианаты, нитрилы) или с раскрытием гетероциклич. группировок (напр., окисей олефинов, лактамов).
Применение. Мех. прочность, эластичность, электроизоляц. и др. ценные техн. св-ва высокомолекулярных соединений обусловливают их широкое применение в разл. отраслях народного хозяйства и в быту. Высокомолекулярные соединения - основа пластических масс, волокон химических, резины, лакокрасочных материалов, клеев, ионообменных смол. Биополимеры составляют основу всех живых организмов и участвуют во всех процессах жизнедеятельности.
