
- •1.Исторический обзор развития термодинамики
- •2. Термодинамическая система.
- •3. Типы термодинамического контакта
- •Термодинамические параметры
- •Термодинамическое состояние
- •Равновесное состояние
- •Уравнения состояния
- •Термодинамические процессы
- •10. Теплота и количество теплоты.
- •11. Внутренняя энергия. Энтальпия.
- •12. Аналитическое выражение первого начала.
- •13. Теплоемкость.
- •14. Изотермический процесс.
- •15. Изобарический процесс.
- •16. Изохорический процесс.
- •17. Адиабатический процесс.
- •18. Политропический процесс.
- •28) Аналитическое выражение второго начала.
- •29) Максимально полезная внешняя работа.
- •31) Свободная энергия Гельмгольца
- •32) Свободная энергия Гиббса.
- •34) Дифференциальные уравнения термодинамики в частных производных.
- •35) Условия равновесия фаз.
- •36) Правило фаз.
- •37.Теплота фазового перехода.
- •38 .Испарение и конденсация
- •39.Критическая точка
- •40. Насыщенный пар
- •41. Влажный пар
- •42. Перегретый пар
- •43. Циклы паросиловых установок
- •44. Циклы газотурбинных установок и реактивных двигателей
- •55. Размерные величины и единицы измерения
- •56. Теория размерностей
- •57. Уравнение теплопроводности
- •58. Одномерная стационарная задача теплопроводности при отсутствии внутреннего тепловыделения
- •59. Влияние переменности коэффициента теплопроводности
- •61. Перенос тепла в ребрах
- •62. Многомерные стационарные задачи теплопроводности
- •63. Нестационарная теплопроводность при пренебрежимо малом внутреннем термическом сопротивлении
- •64.Нестационарная теплопроводность в полу бесконечном твердом теле.
- •65.Диаграммы для решения задач нестационарной теплопроводности
- •66.Численные решения задач нестационарной теплопроводности
- •67. Уравнения сохранении массы, количества движения и энергии при ламинарном обтекании плоской пластины
- •68. Интегральные уравнения количества движения и энергии для ламинарного пограничного слоя
- •69. Расчет коэффициентов теплоотдачи и трения в ламинарном потоке
- •70.Аналогия между теплообменом и переносом количества движения при турбулентном обтекании плоской пластины
- •71.Аналогия Рейнольдса при турбулентном обтекании плоской пластины
- •72 Вынужденная конвекция при ламинарном течений в трубе
- •73 Безразмерные комплексы, используемые для обобщения экспериментальных данных по конвективному теплообмену
- •74 Конвективный теплообмен при течении в трубах и каналах
- •76 Свободная конвекция
- •77 Смешанная свободная и вынужденная конвекция
- •78 Теплообмен в высокоскоростном потоке
- •79 Физика излучения
- •80 Радиационные свойства
- •81 Угловой коэффициент излучения
- •82. Теплообмен излучением между серыми поверхностями
- •83. Матричный метод
- •84.Перенос излучения в поглощающих пропускающих средах
- •85. Радиационные свойства газов
- •86 Солнечное излучение
- •87 Основные типы теплообменников
- •88.Суммарный коэффициент теплопередачи
- •89. Среднелогарифмическая разность температур
- •90. Эффективность теплообменника
29) Максимально полезная внешняя работа.
Максимальная
полезная внешняя работа  представляет
собой работу, которую производит система
над внешним теплоизолированным от
системы объектом работы в обратимом
процессе 1-2 работу, которую должен
затратить внешний источник работы,
чтобы вернуть систему из состояния 2 в
исходное состояние 1 в тех же самых
условиях, т.е. работу обратного обратимого
процесса 2 - 1 называют минимальной
работой; при этом
представляет
собой работу, которую производит система
над внешним теплоизолированным от
системы объектом работы в обратимом
процессе 1-2 работу, которую должен
затратить внешний источник работы,
чтобы вернуть систему из состояния 2 в
исходное состояние 1 в тех же самых
условиях, т.е. работу обратного обратимого
процесса 2 - 1 называют минимальной
работой; при этом  .
.
В самом
общем случае
состоит
из двух частей: работы, связанной с
изменением объёма, и работы  ,
не связанной с изменением объёма.
,
не связанной с изменением объёма.
В
дальнейшем рассматриваются следующие
два случая: 1) работа производится
одиночным однородным телом при наличии
источников тепла разной температуры;
2) работа производится телом. Находящимся
в окружающей среде, давление ![]() и
температура
и
температура ![]() которой
неизменны.
которой
неизменны.
30) Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергиивсегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
31) Свободная энергия Гельмгольца
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
![]() ,
где U — внутренняя
энергия, T —
абсолютная температура, S —энтропия.
,
где U — внутренняя
энергия, T —
абсолютная температура, S —энтропия.
Отсюда дифференциал свободной энергии равен:
![]() .
.
Видно,
что это выражение является полным
дифференциалом относительно независимых
переменных T и V.
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию ![]() .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
![]() ,
,
32) Свободная энергия Гиббса.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, илитермодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкостии т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
33) Химический потенциал.
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу частиц в системе:
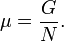
Если система состоит из частиц нескольких сортов i с числом Ni частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению
![]()
Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса-Дюгема и из условий равенства химических потенциалов μ1 = μ2 находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона-Клаузиуса, определяющее линию сосуществования двух фаз в координатах(p,T) через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами.
