
- •1.Исторический обзор развития термодинамики
- •2. Термодинамическая система.
- •3. Типы термодинамического контакта
- •Термодинамические параметры
- •Термодинамическое состояние
- •Равновесное состояние
- •Уравнения состояния
- •Термодинамические процессы
- •10. Теплота и количество теплоты.
- •11. Внутренняя энергия. Энтальпия.
- •12. Аналитическое выражение первого начала.
- •13. Теплоемкость.
- •14. Изотермический процесс.
- •15. Изобарический процесс.
- •16. Изохорический процесс.
- •17. Адиабатический процесс.
- •18. Политропический процесс.
- •28) Аналитическое выражение второго начала.
- •29) Максимально полезная внешняя работа.
- •31) Свободная энергия Гельмгольца
- •32) Свободная энергия Гиббса.
- •34) Дифференциальные уравнения термодинамики в частных производных.
- •35) Условия равновесия фаз.
- •36) Правило фаз.
- •37.Теплота фазового перехода.
- •38 .Испарение и конденсация
- •39.Критическая точка
- •40. Насыщенный пар
- •41. Влажный пар
- •42. Перегретый пар
- •43. Циклы паросиловых установок
- •44. Циклы газотурбинных установок и реактивных двигателей
- •55. Размерные величины и единицы измерения
- •56. Теория размерностей
- •57. Уравнение теплопроводности
- •58. Одномерная стационарная задача теплопроводности при отсутствии внутреннего тепловыделения
- •59. Влияние переменности коэффициента теплопроводности
- •61. Перенос тепла в ребрах
- •62. Многомерные стационарные задачи теплопроводности
- •63. Нестационарная теплопроводность при пренебрежимо малом внутреннем термическом сопротивлении
- •64.Нестационарная теплопроводность в полу бесконечном твердом теле.
- •65.Диаграммы для решения задач нестационарной теплопроводности
- •66.Численные решения задач нестационарной теплопроводности
- •67. Уравнения сохранении массы, количества движения и энергии при ламинарном обтекании плоской пластины
- •68. Интегральные уравнения количества движения и энергии для ламинарного пограничного слоя
- •69. Расчет коэффициентов теплоотдачи и трения в ламинарном потоке
- •70.Аналогия между теплообменом и переносом количества движения при турбулентном обтекании плоской пластины
- •71.Аналогия Рейнольдса при турбулентном обтекании плоской пластины
- •72 Вынужденная конвекция при ламинарном течений в трубе
- •73 Безразмерные комплексы, используемые для обобщения экспериментальных данных по конвективному теплообмену
- •74 Конвективный теплообмен при течении в трубах и каналах
- •76 Свободная конвекция
- •77 Смешанная свободная и вынужденная конвекция
- •78 Теплообмен в высокоскоростном потоке
- •79 Физика излучения
- •80 Радиационные свойства
- •81 Угловой коэффициент излучения
- •82. Теплообмен излучением между серыми поверхностями
- •83. Матричный метод
- •84.Перенос излучения в поглощающих пропускающих средах
- •85. Радиационные свойства газов
- •86 Солнечное излучение
- •87 Основные типы теплообменников
- •88.Суммарный коэффициент теплопередачи
- •89. Среднелогарифмическая разность температур
- •90. Эффективность теплообменника
Термодинамические процессы
Тепловой процесс (термодинамический процесс) — изменение макроскопического состояния термодинамической системы.
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесные и неравновесные. Равновесным называется процесс, при котором все состояния, через которые проходит система, являются равновесными состояниями. Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объем, энтропия) в условиях изолированности от окружающей среды.
Тепловые процессы можно разделить на обратимые и необратимые. Обратимым называется процесс, который можно провести в противоположном направлении через все те же самые промежуточные состояния.
Можно выделить несколько тепловых процессов:
Адиабатный процесс (q = 0) — происходящий без теплообмена с окружающей средой;
Изохорный процесс (v= const) — происходящий при постоянном объёме;
Изобарный процесс (р = const) — происходящий при постоянном давлении;
Изотермический процесс (Т = const) — происходящий при постоянной температуре;
Изоэнтропийный процесс — происходящий при постоянной энтропии;
Изоэнтальпийный процесс — происходящий при постоянной энтальпии;
Политропный процесс — происходящий при постоянной теплоёмкости;
Теория тепловых процессов применяется для проектирования двигателей, холодильных установок, в химической промышленности, в метеорологии.
Работа
В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Но скорости молекул тела меняются. Поэтому меняется температура тела. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
Механическая работа:

где
![]() — сила, а
— сила, а
![]() — элементарное (бесконечно малое)
перемещение.
— элементарное (бесконечно малое)
перемещение.
Элементарная работа термодинамической системы над внешней средой:
![]()
где
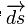 — нормаль элементарной (бесконечно
малой) площадки, P — давление и dV —
бесконечно малое приращение объёма.
— нормаль элементарной (бесконечно
малой) площадки, P — давление и dV —
бесконечно малое приращение объёма.
Работа в термодинамическом процессе 12 выражается так:
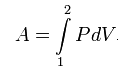
Величина работы зависит от пути, по которому термодинамическая система переходит из состояния 1 в состояние 2, и не является функцией состояния системы. Такие величины называют функциями процесса.
10. Теплота и количество теплоты.
Теплота. Работа считается положительной, если ее совершает система. Теплота считается положительной если система ее получает.
Количество теплоты – кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит. Мерой интенсивности движения молекул является температура. Количество теплоты, которым обладает тело при данной температуре, зависит от его массы; например, при одной и той же температуре в большой чашке с водой заключается больше теплоты, чем в маленькой, а в ведре с холодной водой его может быть больше, чем в чашке с горячей водой (хотя температура воды в ведре и ниже).
Количество теплоты является одной из основных термодинамических величин. Она является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от пути в соответствующих термодинамических координатах, по которому она была приведена в текущее состояние.
Количество теплоты фигурирует в первом начале термодинамики:
 ,
,
где
![]() —
внутренняя энергия, а
—
внутренняя энергия, а
![]() —
работа системы над
внешними телами. В дифференциальной
форме:
—
работа системы над
внешними телами. В дифференциальной
форме:
 .
.
