
- •1.Термодинамика и ее метод исследования.
- •2.Параметры термодинамической системы. Температура.
- •3.Параметры термодинамической системы. Давление.
- •4.Параметры термодинамической системы. Удельный объем.
- •6.Внутренняя энергия системы.
- •7.Энтальпия.
- •8.Понятие термодинамического процесса и термодинамическое равновесие.
- •9.Работа. Свойства p-V диаграмм.
- •10.Теплота.Свойства t-s диаграмм.
- •11.Первый закон термодинамики для замкнутого пространства.
- •12.Второй закон термодинамики. Обратимые и необратимые процессы.
- •13.Идеальный газ. Уравнение Клапейрона-Менделеева.
- •14. Газовая постоянная. Универсальная газовая постоянная.
- •15.Реальные газы. Уравнение состояния реальных газов.
- •16.Смеси идеальных газов и их свойства. Определение состава смеси.
- •17.Закон Дальтoна. Парциальное давление.
- •18.Газовая постоянная и средняя молярная масса смеси.
- •19.Понятия и определения теплоемкости.
- •20.Теплоемкость смеси идеальных газов.
- •21.Изотермический процесс.
- •22.Изобарный процесс.
- •23.Изохорный процесс.
- •24.Адиабатный процесс.
- •25.Политpoпные процессы.
- •27. Уравнение неразрывности потока
- •28. Связь между параметрами и функциями состояния в адиабатном потоке
- •29. Сопло и диффузор. Комбинированное сопло Лаваля.
- •31.Понятие о тепловых машинах. Холодильные машины и тепловые двигатели
- •32. Цикл Карно и его кпд
- •33 Циклы двс с подводом теплоты при постоянном объеме
- •34 Циклы двс с подводом теплоты при постоянном давлении
- •35.Цикл двс со смешанным подводом теплоты
- •37. Тепловой поток. Температурное поле. Градиент температуры.
- •38. Основные процессы теплопереноса. Теплопроводность.
- •39. Основные процессы теплопереноса. Конвекция.
- •40. Основные процессы теплопереноса. Тепловое излучение.
- •41. Дифференциальные уравнения процесса теплообмена.
- •49 . Теплопроводность при граничных условиях III рода. Цилиндрическая стенка.
- •51.Критерии гидродинамического подобия, критерии Фруда, Эйлера, Рейнольдса.
- •53. Вынужденная конвекция. Число Рейнольдса. Режимы течения.
- •54. Свободная конвекция. Число Грасгофа.
- •55 . Критерий подобия поля температур и скоростей. Число Прандтля.
- •58. Теплообмен при вынужденном движении жидкости вдоль плоской стенки
- •59.Теплообмен при вынужденном движении жидкости вдоль
- •60 Теплообмен при поперечном обтекании пучка труб
18.Газовая постоянная и средняя молярная масса смеси.
Газовая постоянная (R) – одна из основных физических постоянных, входит в уравнение состояния 1 моля идеального газа: pV = RT, где р – давление, V – объем моля газа, Т – абсолютная температура. Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K.
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)
Уравнение для нахождения удельной газовой постоянной смеси:
R = еgiRi= 8314,2(g1/ M1+ g2/ M2+… + gn/ Mn)
Зная молярную массу смеси, можно найти газовую постоянную смеси:
R = 8,314 / M.
Зная объемный состав смеси, получим следующие формулы:
gi= (R / Ri),
еgi = Rе(ri / Ri) = 1.
Формула для вычисления удельной газовой постоянной примет вид:
R= 1 / е(ri/Ri) = 1 / (r1/ R1 + R2+… + rn / Rn).
Средняя молярная масса смеси газов является достаточно условной величиной:
M = 8314,2 / R,
M= 8314,2 / (g1R1+ g2R2 +. + gnRn).
Если произвести замену удельных газовых постоянных R1, R2,…, Rn их значениями из уравнения Клайперона, найдем среднюю молярную массу смеси газов, если смесь определяется массовыми долями:
M= 1 / (r1/ M1+ r2/ M2+. + rn/ Mn).
В случае, когда смесь определяется объемными долями, получаем следующее выражение:
R= 1 / еriRi = 8314,2 / еriMi.
Зная, что R = 8314,2 / M, получим:
M= еriMi = r1M1 + r2M2 +. + rnMn.
Таким образом, средняя молярная масса смеси газов определяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь.
19.Понятия и определения теплоемкости.
Под
теплоемкостью тела понимают кол-во
тепла которое необходимо сообщить телу
для того чтобы нагреть его на один
градус. Из этого определения следует,
что теплоемкость вещества является
экстенсивным свойством тела. Величина
теплоемкости данного тела тем больше
чем больше вещества в теле. Удельная
теплоемкость:
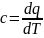 .
.
Средняя
и истинная теплоемкость. Значение
средней теплоемкости
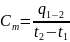 Теплоемкость не является постоянной
величиной, она изменяется с изм.
температуры, причем в ряде случаев эта
зависимость значительна.
Теплоемкость не является постоянной
величиной, она изменяется с изм.
температуры, причем в ряде случаев эта
зависимость значительна.

Чем
больше используется членов тем точнее
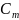 .
Значение истинной теплоемкости
определяется как производная от
количества тепла подводимого к телу в
процессе нагрева к температуре этого
тела:
.
Значение истинной теплоемкости
определяется как производная от
количества тепла подводимого к телу в
процессе нагрева к температуре этого
тела:
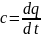 .
.
 .
.
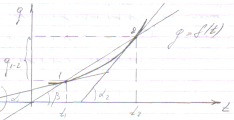
на
графике может быть интерпретирована
как tg
угла секущей проходящей ч\з точки 1 и 2.
 , а истинная теплоемкость в сост. 1 и 2 -
, а истинная теплоемкость в сост. 1 и 2 -
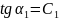 ,
,
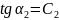 .
.
Величина
удельного кол-ва тепла зависит не только
от интервала температур но и от вида
процесса. Поэтому величина q
должна быть снабжена индексом хар-им
вид процесса.
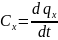 . Наиболее часто используются теплоемкости
изобарного и изохорного процессов.
. Наиболее часто используются теплоемкости
изобарного и изохорного процессов.
20.Теплоемкость смеси идеальных газов.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Для определения теплоемкости смеси газов необходимо знать состав смеси и теплоемкость отдельных газов, входящих в смесь.
Предположим,
что состав смеси задан массовыми долями
компонентов. Напишем выражения для
количества теплоты, сообщаемого i-му
газу:
 и к смеси газов
и к смеси газов
 Очевидно, что
Очевидно, что
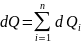 .
.
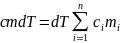 .
Отсюда удельная теплоемкость газовой
смеси
.
Отсюда удельная теплоемкость газовой
смеси
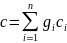 ;
молярная
теплоемкость
;
молярная
теплоемкость
 .
Применяя формула перехода от массовых
долей к объемным, получим:
.
Применяя формула перехода от массовых
долей к объемным, получим:
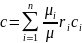 и
и
 .
.
