
- •1.Термодинамика и ее метод исследования.
- •2.Параметры термодинамической системы. Температура.
- •3.Параметры термодинамической системы. Давление.
- •4.Параметры термодинамической системы. Удельный объем.
- •6.Внутренняя энергия системы.
- •7.Энтальпия.
- •8.Понятие термодинамического процесса и термодинамическое равновесие.
- •9.Работа. Свойства p-V диаграмм.
- •10.Теплота.Свойства t-s диаграмм.
- •11.Первый закон термодинамики для замкнутого пространства.
- •12.Второй закон термодинамики. Обратимые и необратимые процессы.
- •13.Идеальный газ. Уравнение Клапейрона-Менделеева.
- •14. Газовая постоянная. Универсальная газовая постоянная.
- •15.Реальные газы. Уравнение состояния реальных газов.
- •16.Смеси идеальных газов и их свойства. Определение состава смеси.
- •17.Закон Дальтoна. Парциальное давление.
- •18.Газовая постоянная и средняя молярная масса смеси.
- •19.Понятия и определения теплоемкости.
- •20.Теплоемкость смеси идеальных газов.
- •21.Изотермический процесс.
- •22.Изобарный процесс.
- •23.Изохорный процесс.
- •24.Адиабатный процесс.
- •25.Политpoпные процессы.
- •27. Уравнение неразрывности потока
- •28. Связь между параметрами и функциями состояния в адиабатном потоке
- •29. Сопло и диффузор. Комбинированное сопло Лаваля.
- •31.Понятие о тепловых машинах. Холодильные машины и тепловые двигатели
- •32. Цикл Карно и его кпд
- •33 Циклы двс с подводом теплоты при постоянном объеме
- •34 Циклы двс с подводом теплоты при постоянном давлении
- •35.Цикл двс со смешанным подводом теплоты
- •37. Тепловой поток. Температурное поле. Градиент температуры.
- •38. Основные процессы теплопереноса. Теплопроводность.
- •39. Основные процессы теплопереноса. Конвекция.
- •40. Основные процессы теплопереноса. Тепловое излучение.
- •41. Дифференциальные уравнения процесса теплообмена.
- •49 . Теплопроводность при граничных условиях III рода. Цилиндрическая стенка.
- •51.Критерии гидродинамического подобия, критерии Фруда, Эйлера, Рейнольдса.
- •53. Вынужденная конвекция. Число Рейнольдса. Режимы течения.
- •54. Свободная конвекция. Число Грасгофа.
- •55 . Критерий подобия поля температур и скоростей. Число Прандтля.
- •58. Теплообмен при вынужденном движении жидкости вдоль плоской стенки
- •59.Теплообмен при вынужденном движении жидкости вдоль
- •60 Теплообмен при поперечном обтекании пучка труб
23.Изохорный процесс.
Изохорный
процесс.
Изохорный
процесс - процесс. происходящий при
постоянном объеме газа:
 .
В соответствии с данным уравнением
изохорный процесс изображается на
диаграмме р-v
вертикальной
прямой. Эта линия называется изохорой
(линия 1–2
- теплота
подводится, давление возрастает; линия
1-2' - теплота отводится, давление
уменьшается). Из уравнения состояния
идеального газа для изохорного процесса
.
В соответствии с данным уравнением
изохорный процесс изображается на
диаграмме р-v
вертикальной
прямой. Эта линия называется изохорой
(линия 1–2
- теплота
подводится, давление возрастает; линия
1-2' - теплота отводится, давление
уменьшается). Из уравнения состояния
идеального газа для изохорного процесса
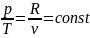 ,
или для процесса 1-2
,
или для процесса 1-2
 .
В изохорном процессе давление газа
пропорционально термодинамической
температуре. Это соотношение представляет
собой закон Шарля. Запишем уравнение
первого закона термодинамики в виде
.
В изохорном процессе давление газа
пропорционально термодинамической
температуре. Это соотношение представляет
собой закон Шарля. Запишем уравнение
первого закона термодинамики в виде
 .
Для изохорного процесса работа изменения
объема не совершается, так как dl=pdv=0.
Поэтому последнее уравнение принимает
вид dq=du,
или для процесса 1-2
.
Для изохорного процесса работа изменения
объема не совершается, так как dl=pdv=0.
Поэтому последнее уравнение принимает
вид dq=du,
или для процесса 1-2
 .
Теплота,
сообщаемая газу или отведенная от
него в изохорном процессе, идет на
изменение внутренней энергии (𝜁=1).
При подведении теплоты внутренняя
энергия газа увеличивается, при отведении
- уменьшается. Элементарное
количество теплоты при изохорном
процессе
.
Теплота,
сообщаемая газу или отведенная от
него в изохорном процессе, идет на
изменение внутренней энергии (𝜁=1).
При подведении теплоты внутренняя
энергия газа увеличивается, при отведении
- уменьшается. Элементарное
количество теплоты при изохорном
процессе
 или
,
откуда, приравнивая правые части
уравнений, определяем изменение энтропии
или
,
откуда, приравнивая правые части
уравнений, определяем изменение энтропии
 ,
или для процесса 1-2:
,
или для процесса 1-2:
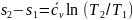 .
График изохорного процесса на диаграмме
Т
-
s
представляет логарифмическую кривую
(кривая 1-2 - тепло подводится, энтропия
и температура возрастают; кривая
1-2'—тепло
отводится, энтропия и температура
уменьшаются). Количество теплоты,
сообщаемое газу или отводимое от него
в процессе 1-2
(2'),
.
График изохорного процесса на диаграмме
Т
-
s
представляет логарифмическую кривую
(кривая 1-2 - тепло подводится, энтропия
и температура возрастают; кривая
1-2'—тепло
отводится, энтропия и температура
уменьшаются). Количество теплоты,
сообщаемое газу или отводимое от него
в процессе 1-2
(2'),
 ;
.
;
.
Внутренняя энергия идеального газа во всех процессах, протекающих в одном и том же интервале температур, изменяется на одну и ту же величину независимо от характера процесса. Вследствие этого выражение ; справедливо для всех процессов идеального газа.
На
диаграмме Т-s
подкасательная
к кривой процесса в любой ее точке
определяет истинное значение удельной
изохорной теплоемкости
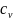 .
Причем чем больше теплоемкость
,
тем
более полого проходит кривая процесса.
Полезная внешняя работа
.
Причем чем больше теплоемкость
,
тем
более полого проходит кривая процесса.
Полезная внешняя работа
 .
Изменение энтальпии в изохорном процессе
определяем из уравнения
.
Изменение энтальпии в изохорном процессе
определяем из уравнения
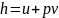 .
Дифференцируем это выражение:
.
Дифференцируем это выражение:
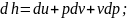 получаем
(pdv=0)
получаем
(pdv=0)
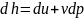 ,
для процесса 1-2
,
для процесса 1-2
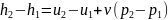 ,
или
,
или
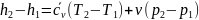 .
.
24.Адиабатный процесс.
Адиабатный
процесс. Адиабатный
процесс протекает без теплообмена
системы с окружающей средой, система
не получает теплоты извне и не отдает
ее. Условие протекания адиабатного
процесса dq=0.
Уравнения первого закона термодинамики
при dq=0
имеют вид
 и
и
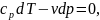 откуда получаем
откуда получаем
 ;
;
 .
Разделив почленно второе уравнение на
превое:
.
Разделив почленно второе уравнение на
превое:
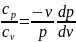 ,
или
,
или
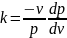 .
После разделения переменных получим
.
После разделения переменных получим
 ,
после интегрирования –
,
после интегрирования –
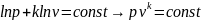 (1).
Или для процесса 1-2
(1).
Или для процесса 1-2
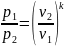 .
Уравнение (1)
является
уравнением адиабатного процесса. При
его выводе предполагалось, что
.
Уравнение (1)
является
уравнением адиабатного процесса. При
его выводе предполагалось, что
 являются постоянными величинами.
Элементарная удельная работа изменения
объема в адиабатном процессе определяется
по формуле
являются постоянными величинами.
Элементарная удельная работа изменения
объема в адиабатном процессе определяется
по формуле
 ,
откуда
,
откуда
 .
Умножив и разделив правую часть выражения
(2)
на
.
Умножив и разделив правую часть выражения
(2)
на
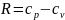 ,
получим
,
получим
 ,
или
,
или
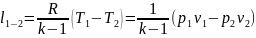 .
Из
первого закона термодинамики следует,
что при
.
Из
первого закона термодинамики следует,
что при
 .
Работа
изменения объема в адиабатном процессе
осуществляется за счет внутренней
энергии системы: при совершении работы
расширения внутренняя энергия газа и
температура уменьшаются, при адиабатном
сжатии газа внутренняя энергия и
температура возрастают.
.
Работа
изменения объема в адиабатном процессе
осуществляется за счет внутренней
энергии системы: при совершении работы
расширения внутренняя энергия газа и
температура уменьшаются, при адиабатном
сжатии газа внутренняя энергия и
температура возрастают.
Полезная
внешняя работа
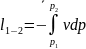 .
Полезная внешняя работа при адиабатном
процессе в k
раз
больше работы изменения объема.
Дифференциал энтропии ds=dq/T,
откуда при dq=0
ds=0,
s=const.
.
Полезная внешняя работа при адиабатном
процессе в k
раз
больше работы изменения объема.
Дифференциал энтропии ds=dq/T,
откуда при dq=0
ds=0,
s=const.
Равновесный адиабатный процесс является процессом изоэнтропным. Из сравнительного анализа уравнений адиабаты и изотермы следует, что адиабата круче изотермы на диаграмме p-v.
