
- •Содержание
- •Расчет теплоты сгорания смеси газов
- •Теоретическая температура горения, тепловой баланс котла
- •Расчет скорости витания частиц твердого топлива в восходящем потоке газа.
- •Диффузия и массообмен
- •Кинетика реакций горения
- •Расчет времени выгорания капли жидкого топлива
- •Состав продуктов взрыва
- •Расчет состава продуктов взрыва
- •Теплота взрыва
- •Основные параметры продуктob взрыва
- •Список литературы
- •Воспламенение природного газа
Диффузия и массообмен
Коэффициент взаимной диффузии для бинарной газообразной смеси можно определять по формуле, см2/с:

где
![]() ,
,
![]() –
молекулярные массы первого и второго
компонента смеси, моль;
–
молекулярные массы первого и второго
компонента смеси, моль;
Р – давление смеси, атм;
![]() – средний диаметр
молекул, Å
– средний диаметр
молекул, Å
![]()
![]() – приведенный
интеграл столкновений (рисунок 2),
учитывающий характер столкновений
молекул. Для модели твердых шаров
(упругое столкновение) равен 1,0.
Определяется по приведенной температуре
– приведенный
интеграл столкновений (рисунок 2),
учитывающий характер столкновений
молекул. Для модели твердых шаров
(упругое столкновение) равен 1,0.
Определяется по приведенной температуре
![]()
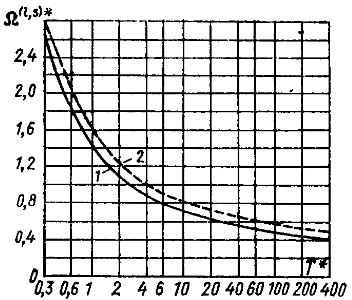
Рисунок 2. Зависимость
![]() от
от
![]()
(для потенциала Леонарда–Джонса):
1 -
![]() ;
2 -
;
2 -
![]()
![]() – наименьшее
значение потенциальной энергии
взаимодействия молекул (глубина
потенциальной ямы). Для бинарных смесей:
– наименьшее
значение потенциальной энергии
взаимодействия молекул (глубина
потенциальной ямы). Для бинарных смесей:
![]()
Пример.
Вычислить
значения коэффициента диффузии для
двухкомпонентной смеси:
![]() и
при атмосферном давлении и при температурах
273 К и 2000 К. Сравнить полученные значения.
и
при атмосферном давлении и при температурах
273 К и 2000 К. Сравнить полученные значения.
Решение:
Исходные данные принимаются по таблице 1.
Таблица 1 - Справочные данные приведены
Газ |
σ , Å |
ε/κ, 0К |
Молекулярная масса, моль |
Н2 |
2,92 |
38,0 |
2 |
Воздух |
3,67 |
84,0 |
28,96 |
N2 |
3,75 |
79,8 |
28 |
O2 |
3,54 |
88,0 |
32 |
CO |
3,71 |
88,0 |
28 |
CO2 |
3,90 |
213,0 |
44 |
CH4 |
3,80 |
144,0 |
16 |
Средний диаметр молекул:
![]() Å;
Å;
Наименьшее значение потенциальной энергии взаимодействия молекул (глубина потенциальной ямы):
![]() ;
;
Приведенная температура:
при
![]()
![]() ;
;
при
![]()
![]() .
.
Определяем приведенный интеграл столкновений, учитывающий характер столкновений молекул:
Исходя из рисунка 1
при
![]()
![]() ;
;
при
![]()
![]() ,
,
тогда
Коэффициент взаимной диффузии:
при

при
![]()

Анализ полученных результатов:

Коэффициенты взаимной диффузии при и при отличаются друг от друга на 95 %.
Кинетика реакций горения
Число соударений молекул А и В в 1 м3 в течение 1 секунды для бинарной смеси можно определять по формуле:
![]() ,
,
Здесь
![]() – средняя
относительная скорость молекул при
температуре Т,
м/с
– средняя
относительная скорость молекул при
температуре Т,
м/с
![]() ,
,
где
![]() – постоянная
Больцмана, равная 1,38·10-23
Дж/К;
– постоянная
Больцмана, равная 1,38·10-23
Дж/К;
![]() – приведенная
масса молекул, кг
– приведенная
масса молекул, кг
![]() ,
,
где
![]() ,
,
![]() - массы молекул А
и В
соответственно, кг;
- массы молекул А
и В
соответственно, кг;
![]() ,
,
![]() – количество молекул А
и В
соответственно в единице объема
(концентрации молекул), определяемые
по уравнению состояния идеального газа,
молекул/м3;
– количество молекул А
и В
соответственно в единице объема
(концентрации молекул), определяемые
по уравнению состояния идеального газа,
молекул/м3;
![]() ,
,
где
![]() - атмосферное давление, Па;
- атмосферное давление, Па;
![]() – сечение соударений,
м2
– сечение соударений,
м2
![]() ,
,
где
![]() ,
,
![]() – радиусы молекул А
и В
соответственно, м.
– радиусы молекул А
и В
соответственно, м.
Число активных столкновений молекул определяется по закону Аррениуса:
![]() ,
,
где
![]() – универсальная газовая постоянная,
равная 8,314 кДж/моль;
– универсальная газовая постоянная,
равная 8,314 кДж/моль;
![]() – энергия активации,
кДж/кмоль.
– энергия активации,
кДж/кмоль.
Скорость реакции, кмоль/(м3·с):
![]() ,
,
где
![]() - число молекул в одном моле (число
Авогадро), равное 6,023·1023
молекул/моль.
- число молекул в одном моле (число
Авогадро), равное 6,023·1023
молекул/моль.
Пример.
Рассматривается
газообразная смесь, состоящая из двух
видов газов А и В при равном мольном
содержании компонент. Массы молекул
газов равны
![]() кг, радиусы молекул соответственно тоже
равны
кг, радиусы молекул соответственно тоже
равны
![]() м, энергия активации
м, энергия активации
![]() кДж/кмоль,
кДж/кмоль,
![]() кДж/моль. Давление смеси атмосферное
(105 Па),
температура смеси
кДж/моль. Давление смеси атмосферное
(105 Па),
температура смеси
![]() К. Определить общее число столкновений
молекул А и В в 1 м3
в течение 1 секунды; долю активных
столкновений молекул; соответствующие
скорости реакций.
К. Определить общее число столкновений
молекул А и В в 1 м3
в течение 1 секунды; долю активных
столкновений молекул; соответствующие
скорости реакций.
Решение:
Приведенная масса молекул:
![]() кг
кг
Средняя относительная скорость молекул:
![]() м/с
м/с
Сечение соударений:
![]() м2
м2
Числа молекул в единице объема (концентрации молекул):
![]() молекул/м3
молекул/м3
Число соударений молекул в 1 м3 в течение 1 секунды:
![]()
Число активных столкновений молекул:
![]()
![]()
Скорость реакции:
![]() кмоль/(м3·с);
кмоль/(м3·с);
![]() кмоль/(м3·с)
кмоль/(м3·с)
