
- •1.Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
- •2.Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
- •3.Эквивалент элемента и вещества. Закон эквивалентов.
- •4. Расчет молярной массы эквивалента простого и сложного вещества.
- •2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (ао).
- •1.Свойства ковалентной связи и способы ее образования.
- •2.Основные типы гибридизации ао. Теория локализованных электронных пар.
- •4.Металлическая связь и ее свойства.
- •5.Водородная связь. Силы межмолекулярного взаимодействия.
- •2.Основы термохимии: закон Гесса и его следствия.
- •3.Тепловые эффекты процессов, термохимические уравнения.
- •4.Энтропия и ее изменение при химических реакциях.
- •5.Энергия Гиббса. Критерии определения реакционной способности
- •1.Закон действия масс для химических систем, константа химического равновесия.
- •3. Основной закон химической кинетики. Константа скорости реакции.
- •4.Кинетическая классификация реакций.
- •6.Катализаторы, каталитические системы.
- •1.Окислительно-восстановительная способность веществ. Типы овр.
- •2.Метод электронного баланса.
- •3.Метод ионно-электронных уравнений.
- •4.Эдс окислительно-восстановительного процесса, направление протекания овр.
- •5.Электродный потенциал. Условные электродные потенциалы.
- •6.Гальванические элементы. Эдс гальванического элемента.
- •7. Электролиз. Законы Фарадея.
- •8.Катодные и анодные процессы при электролизе водных растворов.
- •9.Коррозия металлов и ее виды. Показатели скорости коррозии.
- •10.Способы защиты металлов от коррозии.
- •1.Способы выражения состава растворов.
- •2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
- •3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
- •5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
- •6.Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
- •7.Произведение растворимости.
- •8.Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОн.
- •9.Ионные реакции, смещение ионного равновесия.
- •10.Гидролиз солей. Константа и степень гидролиза.
- •11.Общие понятия о дисперсных системах.
- •12.Коллоидные растворы и методы их получения.
- •13.Оптические и электрические свойства коллоидных растворов.
- •14.Коагуляция, седиментация и пептизация коллоидных растворов.
3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
Закон: Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
,где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(моль×К);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
Процесс самопроизвольного перехода растворителя
(диффузия) через полупроницаемую мембрану, называемый осмосом.
Давление, которое необходимо приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением. Если давление, приложенное к более концентрированному раствору, больше осмотического, то растворитель будет переходить из раствора в растворитель. Процесс носит название обратный осмос и используется для очистки природных и сточных вод, в частности, может быть использован для водоподготовки в теплоэнергетике.
Зависимость осмотического давления от температуры и концентрации описывается уравнением:
π = с(В)RT, где π – осмотическое давление; с(В) – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная; T – температура, К.
4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
2-й закон Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально их моляльной концентрации.
Математические выражения:
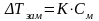
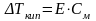
Коэффициенты пропорциональности К и Е называются:
К - криоскопическая константа
Е - эбуллиоскопическая константа -
Коэффициенты К и Е являются характеристиками данного растворителя и показывают понижение температуры замерзания или повышение температуры кипения вызываемое растворением 1 моль вещества в 1 кг этого растворителя. Величины табличные для каждого растворителя.
5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Основными положениями теории электролитической диссоциации
являются следующие:
1. Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может происходить при плавлении твердых электролитов (термическая диссоциация электролитов).
2. Ионы отличаются от атомов составом и свойствами. В водных растворах ионы находятся вгидратированном состоянии. Свойства гидратированных ионов и ионов в газообразном состоянии вещества различны.
3. В растворах или расплавах электролитов ионы движутся хаотично. При пропускании через раствор или расплав электрического тока, ионы движутся направленно: катионы – к катоду, анионы – к аноду. Раствор или расплав электролита является проводником с ионной проводимостью – проводником II рода.
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
По
степени диссоциации различают сильные
электролиты ![]() слабые
электролиты
слабые
электролиты ![]() и
электролиты средней силы
и
электролиты средней силы ![]()
Коллигативными называются свойства растворов, которые не зависят от природы растворенного вещества, а только от его концентрации. Такие свойства проявляются в полной мере в идеальных растворах.
Идеальными называются растворы, при образовании которых не происходит изменения энтальпии и объема системы, не идут химические реакции между компонентами, а силы межмолекулярного взаимодействия между всеми компонентами одинакова. Наиболее близки к идеальным – разбавленные растворы неэлектролитов.
Для бесконечно разбавленных растворов, состояние которых близко к состоянию идеальных, такими свойствами являются:
– осмотическое давление;
– понижение давления насыщенного пара над раствором;
– повышение температуры кипения;
– понижение температуры замерзания раствора.
Изучение коллигативных свойств разбавленных растворов используется для определения молярной массы растворенного вещества, а также его степени диссоциации или показателя ассоциации.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрациипри неизменных прочих параметрах системы:
![]() ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
