
- •1.Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
- •2.Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
- •3.Эквивалент элемента и вещества. Закон эквивалентов.
- •4. Расчет молярной массы эквивалента простого и сложного вещества.
- •2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (ао).
- •1.Свойства ковалентной связи и способы ее образования.
- •2.Основные типы гибридизации ао. Теория локализованных электронных пар.
- •4.Металлическая связь и ее свойства.
- •5.Водородная связь. Силы межмолекулярного взаимодействия.
- •2.Основы термохимии: закон Гесса и его следствия.
- •3.Тепловые эффекты процессов, термохимические уравнения.
- •4.Энтропия и ее изменение при химических реакциях.
- •5.Энергия Гиббса. Критерии определения реакционной способности
- •1.Закон действия масс для химических систем, константа химического равновесия.
- •3. Основной закон химической кинетики. Константа скорости реакции.
- •4.Кинетическая классификация реакций.
- •6.Катализаторы, каталитические системы.
- •1.Окислительно-восстановительная способность веществ. Типы овр.
- •2.Метод электронного баланса.
- •3.Метод ионно-электронных уравнений.
- •4.Эдс окислительно-восстановительного процесса, направление протекания овр.
- •5.Электродный потенциал. Условные электродные потенциалы.
- •6.Гальванические элементы. Эдс гальванического элемента.
- •7. Электролиз. Законы Фарадея.
- •8.Катодные и анодные процессы при электролизе водных растворов.
- •9.Коррозия металлов и ее виды. Показатели скорости коррозии.
- •10.Способы защиты металлов от коррозии.
- •1.Способы выражения состава растворов.
- •2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
- •3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
- •5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
- •6.Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
- •7.Произведение растворимости.
- •8.Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОн.
- •9.Ионные реакции, смещение ионного равновесия.
- •10.Гидролиз солей. Константа и степень гидролиза.
- •11.Общие понятия о дисперсных системах.
- •12.Коллоидные растворы и методы их получения.
- •13.Оптические и электрические свойства коллоидных растворов.
- •14.Коагуляция, седиментация и пептизация коллоидных растворов.
10.Способы защиты металлов от коррозии.
Я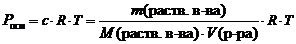 вление
коррозии материалов наносит огромный
ущерб экономике любой страны, поэтому
разработаны меры по защите материалов
от коррозии: легирование металлов,
нанесение защитных покрытий, методы
электрохимической защиты, применение
замедлителей (ингибиторов)
коррозии и приемы рационального
конструирования изделий из металлов.
Одним из самых доступных и чаще всего
применяемых методов защиты является
нанесение на металлы покрытий, которые
бывают металлическими и неметаллическими.
Материалами для металлических покрытий
могут служить как чистые металлы (цинк,
кадмий, алюминий, никель, медь, хром и
др.), так и их сплавы (бронза, латунь и
др.). По характеру поведения металлических
покрытий при коррозии их делят на
катодные и анодные. К катодным
покрытиям
относят покрытия, выполненные из
металлов, имеющих большее значение
потенциала, чем у основного (защищаемого)
металла. При повреждении такого покрытия
возникает макрогальванический элемент,
в котором защищаемый металл становится
анодом и растворяется, а металл покрытия
– катодом, на котором восстанавливаются
частицы окислителя. Таким образом,
катодные покрытия являются защитными,
только пока они не повреждены. Анодные
покрытия
имеют более отрицательный потенциал,
чем потенциал основного металла. В
случае повреждения анодного покрытия
его защитное действие не прекращается,
так как в созданном гальваническом
элементе основной металл – катод (то
есть не окисляется), а металл покрытия
– анод.
вление
коррозии материалов наносит огромный
ущерб экономике любой страны, поэтому
разработаны меры по защите материалов
от коррозии: легирование металлов,
нанесение защитных покрытий, методы
электрохимической защиты, применение
замедлителей (ингибиторов)
коррозии и приемы рационального
конструирования изделий из металлов.
Одним из самых доступных и чаще всего
применяемых методов защиты является
нанесение на металлы покрытий, которые
бывают металлическими и неметаллическими.
Материалами для металлических покрытий
могут служить как чистые металлы (цинк,
кадмий, алюминий, никель, медь, хром и
др.), так и их сплавы (бронза, латунь и
др.). По характеру поведения металлических
покрытий при коррозии их делят на
катодные и анодные. К катодным
покрытиям
относят покрытия, выполненные из
металлов, имеющих большее значение
потенциала, чем у основного (защищаемого)
металла. При повреждении такого покрытия
возникает макрогальванический элемент,
в котором защищаемый металл становится
анодом и растворяется, а металл покрытия
– катодом, на котором восстанавливаются
частицы окислителя. Таким образом,
катодные покрытия являются защитными,
только пока они не повреждены. Анодные
покрытия
имеют более отрицательный потенциал,
чем потенциал основного металла. В
случае повреждения анодного покрытия
его защитное действие не прекращается,
так как в созданном гальваническом
элементе основной металл – катод (то
есть не окисляется), а металл покрытия
– анод.
Растворы. Дисперсные системы.
1.Способы выражения состава растворов.
1.Массовая доля – отношение массы растворенного вещества к массе раствора
ω(в-ва) = m(в-ва)/m(р-ра)
2.Объемная доля – отношение объема газа к объему всей смеси газов
φ(газа) = V(газа)/V(смеси)
3.Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя
χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра))
4.Моляльная концентрация, или моляльность – отношение количества вещества к массе растворителя
B(в-ва) = n(в-ва)/m(р-ля) (моль/кг)
5.Массовая концентрация – отношение массы вещества к объему раствора
Р(в-ва) = m(в-ва)/V(р-ра) (г/л)
6.Титр – масса растворенного в-ва в 1 мл раствора
Т(в-ва) = m(в-ва)/V(р-ра) (г/мл)
7.Молярная концентрация – отношение количества растворенного вещества к объему раствора
С(в-ва) = n(в-ва)/V(р-ра) (моль/л)
8.Коэффициент растворимости – характеристика раствора, означающая число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя. Измеряется в m (г) вещества на 100 г растворителя.
2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
РАУЛЯ ЗАКОН: относит. понижение парциального давления пара р-рителя над разб. бинарным р-ром неэлектролита равно молярной доле растворенного в-ва xв:
![]() где
рА-парциальное давление р-рителя,
РА0-давление
на-сыщ. пара чистого
р-рителя.
где
рА-парциальное давление р-рителя,
РА0-давление
на-сыщ. пара чистого
р-рителя.
Из закона Рауля следует, что повышение температуры кипения или понижение температуры замерзания разбавленного раствора по сравнению с чистым растворителем пропорционально молярной концентрации (или мольной доле) растворенного вещества и может быть использовано для определения его молекулярной массы.
