
- •1.Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
- •2.Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
- •3.Эквивалент элемента и вещества. Закон эквивалентов.
- •4. Расчет молярной массы эквивалента простого и сложного вещества.
- •2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (ао).
- •1.Свойства ковалентной связи и способы ее образования.
- •2.Основные типы гибридизации ао. Теория локализованных электронных пар.
- •4.Металлическая связь и ее свойства.
- •5.Водородная связь. Силы межмолекулярного взаимодействия.
- •2.Основы термохимии: закон Гесса и его следствия.
- •3.Тепловые эффекты процессов, термохимические уравнения.
- •4.Энтропия и ее изменение при химических реакциях.
- •5.Энергия Гиббса. Критерии определения реакционной способности
- •1.Закон действия масс для химических систем, константа химического равновесия.
- •3. Основной закон химической кинетики. Константа скорости реакции.
- •4.Кинетическая классификация реакций.
- •6.Катализаторы, каталитические системы.
- •1.Окислительно-восстановительная способность веществ. Типы овр.
- •2.Метод электронного баланса.
- •3.Метод ионно-электронных уравнений.
- •4.Эдс окислительно-восстановительного процесса, направление протекания овр.
- •5.Электродный потенциал. Условные электродные потенциалы.
- •6.Гальванические элементы. Эдс гальванического элемента.
- •7. Электролиз. Законы Фарадея.
- •8.Катодные и анодные процессы при электролизе водных растворов.
- •9.Коррозия металлов и ее виды. Показатели скорости коррозии.
- •10.Способы защиты металлов от коррозии.
- •1.Способы выражения состава растворов.
- •2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
- •3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
- •5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
- •6.Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
- •7.Произведение растворимости.
- •8.Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОн.
- •9.Ионные реакции, смещение ионного равновесия.
- •10.Гидролиз солей. Константа и степень гидролиза.
- •11.Общие понятия о дисперсных системах.
- •12.Коллоидные растворы и методы их получения.
- •13.Оптические и электрические свойства коллоидных растворов.
- •14.Коагуляция, седиментация и пептизация коллоидных растворов.
8.Катодные и анодные процессы при электролизе водных растворов.
Электролизом
называют окислительно-восстановительный
процесс, протекающий при прохождении
постоянного электрического тока через
раствор или расплав электролита.
Различают электролиз расплавов и
электролиз водных растворов. Электролиз
водных
растворов электролитов
более сложен, так как кроме ионов
электролита на электродах могут
претерпевать изменение молекулы воды:
1) восстанавливаться на катоде по схеме
2Н2О
+ 2ē
Н2
+ 2ОН–.
2) окисляться
на аноде по схеме 2Н2О
– 4ē
О2
+ 4Н+.
Таким
образом, при электролизе водных растворов
электролитов на каждом из электродов
принципиально возможно протекание
двух или большего числа процессов. Из
ряда конкурирующих процессов на
электроде в первую очередь реализуется
тот процесс, осуществление которого
связано с меньшими затратами энергии.
Это означает: 1.На
катоде восстанавливаются в первую
очередь окисленные формы систем с
наибольшим значением
окислительно-восстановительного
потенциала;
2.На
аноде в первую очередь окисляются
восстановленные формы систем, которые
имеют меньшее значение
окислительно-восстановительного
потенциала. При
реализации данных принципов на практике
следует вычислить потенциалы всех
возможных процессов и сравнить их между
собой. На катоде при этом могут возникнуть
три случая: 1.Потенциал
восстановления катиона Е больше потенциала восстановления воды
Е
больше потенциала восстановления воды
Е ,
причем абсолютная разность между
потенциалами конкурирующих процессов
Е
превышает
0,1 В. В этом случае, на катоде
восстанавливаются катионы металла
Mеn+
+ nē
Me.
2.Е
,
причем абсолютная разность между
потенциалами конкурирующих процессов
Е
превышает
0,1 В. В этом случае, на катоде
восстанавливаются катионы металла
Mеn+
+ nē
Me.
2.Е <
Е
<
Е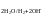 ,
причем
,
причем
![]() В, тогда на катоде идет процесс
восстановления молекул воды. 3.Е
В, тогда на катоде идет процесс
восстановления молекул воды. 3.Е
Е
,
то есть
Е
,
то есть
 В, тогда на катоде идут сразу оба
восстановительных процесса: Mеn+
+ 2Н2О
+ (2 + n) ē
Me
+ Н2
+ 2ОН–.
Для процессов на аноде в первую очередь
следует определить тип анода. Если анод
растворимый, то тогда независимо от
состава электролита будет происходить
окисление материала анода. Например,
для железного анода Fe
– 2ē
Fe2+.
Если анод инертный, то окислению будет
подвергаться одна из частиц электролита
(анион или молекула воды). Для реальных
процессов окисления на инертном аноде
выполняется следующее: 1.В
первую очередь на инертных анодах в
разбавленных водных растворах окисляются
простые анионы в порядке возрастания
их стандартных потенциалов, не превышающих
+1,5 В, то есть S2–,
I–,
Br–,
Cl–.
Вода при этом не окисляется. 2.При
электролизе водных растворов, содержащих
анионы кислородсодержащих кислот (СО
В, тогда на катоде идут сразу оба
восстановительных процесса: Mеn+
+ 2Н2О
+ (2 + n) ē
Me
+ Н2
+ 2ОН–.
Для процессов на аноде в первую очередь
следует определить тип анода. Если анод
растворимый, то тогда независимо от
состава электролита будет происходить
окисление материала анода. Например,
для железного анода Fe
– 2ē
Fe2+.
Если анод инертный, то окислению будет
подвергаться одна из частиц электролита
(анион или молекула воды). Для реальных
процессов окисления на инертном аноде
выполняется следующее: 1.В
первую очередь на инертных анодах в
разбавленных водных растворах окисляются
простые анионы в порядке возрастания
их стандартных потенциалов, не превышающих
+1,5 В, то есть S2–,
I–,
Br–,
Cl–.
Вода при этом не окисляется. 2.При
электролизе водных растворов, содержащих
анионы кислородсодержащих кислот (СО ,
NO
,
NO ,
SO
,
SO и
др.), данные анионы не окисляются, вместо
них на аноде окисляются молекулы воды
по схеме 2Н2О
– 4ē
О2
+ 4Н+,
а в щелочных растворах – ионы ОН–
по схеме4 ОН–
– 4ē
О2
+ 2Н2О.
и
др.), данные анионы не окисляются, вместо
них на аноде окисляются молекулы воды
по схеме 2Н2О
– 4ē
О2
+ 4Н+,
а в щелочных растворах – ионы ОН–
по схеме4 ОН–
– 4ē
О2
+ 2Н2О.
9.Коррозия металлов и ее виды. Показатели скорости коррозии.
Коррозия – это самопроизвольное разрушение металлов или сплавов металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии. Причиной коррозионных разрушений является термодинамическая неустойчивость материалов в естественных условиях, т.е. изменение энергии Гиббса процесса коррозии G < 0. По механизму протекания различают химическую и электрохимическую коррозию. Химическая коррозия протекает в средах, не проводящих электрический ток, таких как сухие газы или растворы неэлектролитов. В результате химической коррозии металл покрывается слоем продуктов его окисления – чаще всего пленкой оксида или гидрооксида. Образующаяся пленка препятствует диффузии окислителя к чистому металлу и тем самым замедляет, а иногда и полностью прекращает дальнейшую коррозию металла. Электрохимическая коррозия наблюдается в средах, способных проводить электрический ток (влажный воздух, вода, водные растворы солей, кислот и оснований, почва и др.). Данный вид коррозии протекает по механизму действия гальванического элемента, в котором окислительный (анодный) и восстановительный (катодный) процессы разделены в пространстве. Окисляющиеся участки металла (анодные участки) имеют меньшее значение потенциала, на них металл в виде ионов переходит в водную среду по реакции Mе – nē Me n+. При этом на металле накапливается отрицательный заряд. На катодных участках, то есть участках с более высоким значением потенциала, восстанавливаются частицы окислителя. Так как окислитель принимает электроны, то есть снимает избыточный отрицательный заряд с поверхности металла (деполяризует его), то его называют деполяризатором. Причинами энергетической неоднородности поверхности металла, которые приводят к образованию короткозамкнутых макро- или микрогальванических пар, являются:
1)наличие контактов двух или более металлов, обладающих различными значениями потенциалов; 2) наличие примесей в металле или продуктов его окисления на поверхности; 3) внутренние напряжения в конструкции из металла и др. Окислителями при электрохимической коррозии чаще всего служат молекулы кислорода, растворенного в воде или ионы Н+.
