
- •1.Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
- •2.Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
- •3.Эквивалент элемента и вещества. Закон эквивалентов.
- •4. Расчет молярной массы эквивалента простого и сложного вещества.
- •2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (ао).
- •1.Свойства ковалентной связи и способы ее образования.
- •2.Основные типы гибридизации ао. Теория локализованных электронных пар.
- •4.Металлическая связь и ее свойства.
- •5.Водородная связь. Силы межмолекулярного взаимодействия.
- •2.Основы термохимии: закон Гесса и его следствия.
- •3.Тепловые эффекты процессов, термохимические уравнения.
- •4.Энтропия и ее изменение при химических реакциях.
- •5.Энергия Гиббса. Критерии определения реакционной способности
- •1.Закон действия масс для химических систем, константа химического равновесия.
- •3. Основной закон химической кинетики. Константа скорости реакции.
- •4.Кинетическая классификация реакций.
- •6.Катализаторы, каталитические системы.
- •1.Окислительно-восстановительная способность веществ. Типы овр.
- •2.Метод электронного баланса.
- •3.Метод ионно-электронных уравнений.
- •4.Эдс окислительно-восстановительного процесса, направление протекания овр.
- •5.Электродный потенциал. Условные электродные потенциалы.
- •6.Гальванические элементы. Эдс гальванического элемента.
- •7. Электролиз. Законы Фарадея.
- •8.Катодные и анодные процессы при электролизе водных растворов.
- •9.Коррозия металлов и ее виды. Показатели скорости коррозии.
- •10.Способы защиты металлов от коррозии.
- •1.Способы выражения состава растворов.
- •2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
- •3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
- •5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
- •6.Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
- •7.Произведение растворимости.
- •8.Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОн.
- •9.Ионные реакции, смещение ионного равновесия.
- •10.Гидролиз солей. Константа и степень гидролиза.
- •11.Общие понятия о дисперсных системах.
- •12.Коллоидные растворы и методы их получения.
- •13.Оптические и электрические свойства коллоидных растворов.
- •14.Коагуляция, седиментация и пептизация коллоидных растворов.
4.Эдс окислительно-восстановительного процесса, направление протекания овр.
Возможность
и полнота самопроизвольного протекания
ОВР в изобарно-изотермических условиях,
как и любого химического процесса,
может быть оценена по знаку изменения
свободной энергии Гиббса системы G
в ходе процесса. Самопроизвольно при
Р, Т
= = const
в прямом направлении могут протекать
реакции, для которых G
< 0. Изменение энергии Гиббса
окислительно-восстановительного
процесса также равно электрической
работе, которую совершает система по
перемещению электронов от восстановителя
к окислителю, то есть
 ,
где Е
– ЭДС окислительно-восстановительного
процесса, В; F
– постоянная Фарадея (F
96 500
Кл/моль); nē
– число электронов, участвующих в
данном процессе. Из этого уравнения
вытекает, что условием самопроизвольного
протекания ОВР в прямом направлении
является положительное значение ЭДС
окислительно-восстановительного
процесса (Е
> 0). Если значение Е
< 0, то реакция идет самопроизвольно
в обратном направлении. Расчет ЭДС ОВР
в стандартных условиях следует вести
по уравнению
,
где Е
– ЭДС окислительно-восстановительного
процесса, В; F
– постоянная Фарадея (F
96 500
Кл/моль); nē
– число электронов, участвующих в
данном процессе. Из этого уравнения
вытекает, что условием самопроизвольного
протекания ОВР в прямом направлении
является положительное значение ЭДС
окислительно-восстановительного
процесса (Е
> 0). Если значение Е
< 0, то реакция идет самопроизвольно
в обратном направлении. Расчет ЭДС ОВР
в стандартных условиях следует вести
по уравнению
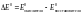 , где
, где
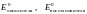 - стандартные окислительно-восстановительные
потенциалы систем. Их значения
определяются экспериментально и
приведены в справочной литературе.
- стандартные окислительно-восстановительные
потенциалы систем. Их значения
определяются экспериментально и
приведены в справочной литературе.
5.Электродный потенциал. Условные электродные потенциалы.
Электродный
потенциал
— разность электрических потенциалов
между электродом и находящимся с ним
в контакте электролитом (чаще всего
между металлом и раствором электролита).
Возникновение электродного потенциала
обусловлено переносом заряженных
частиц через границу раздела фаз,
специфической адсорбцией ионов, а при
наличии полярных молекул (в том числе
молекул растворителя) — ориентационной
адсорбцией их. Величина электродного
потенциала в неравновесном состоянии
зависит как от природы и состава
контактирующих фаз, так и от кинетических
закономерностей электродных реакций
на границе раздела фаз. Равновесное
значение скачка потенциалов на границе
раздела электрод/раствор определяется
исключительно особенностями электродной
реакции и не зависит от природы электрода
и адсорбции на нём поверхностно-активных
веществ. Эту абсолютную разность
потенциалов между точками, находящимися
в двух разных фазах, нельзя измерить
экспериментально или рассчитать
теоретически. Каждый электрод
характеризуется определенным значением
условного электродного потенциала
Е,
который в стандартных условиях
определяется экспериментально
относительно потенциала стандартного
водородного электрода
(СВЭ). СВЭ – это газовый электрод, который
состоит из платины, контактирующей с
газообразным водородом (Р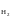 =
1 атм) и раствором, в котором активность
ионов водорода а
=
1 атм) и раствором, в котором активность
ионов водорода а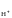 =
1 моль/дм3.
Равновесие в водородном электроде
отражается уравнением Н+
+
=
1 моль/дм3.
Равновесие в водородном электроде
отражается уравнением Н+
+
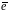
½ Н2.
Абсолютное
значение потенциала СВЭ неизвестно,
но условно его считают равным нулю (Е
½ Н2.
Абсолютное
значение потенциала СВЭ неизвестно,
но условно его считают равным нулю (Е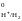 =
0 В).
=
0 В).
6.Гальванические элементы. Эдс гальванического элемента.
Процессы
превращения энергии химической реакции
в электрическую лежат в основе работы
химических
источников тока
(ХИТ). К ХИТ относятся гальванические
элементы, аккумуляторы и топливные
элементы. Гальваническим
элементом
называют устройство для прямого
преобразования энергии химической
реакции в электрическую, в котором
реагенты (окислитель и восстановитель)
входят непосредственно в состав элемента
и расходуются в процессе его работы.
После расхода реагентов элемент не
может больше работать, то есть это –
ХИТ одноразового действия. Гальванический
элемент состоит их двух полуэлементов
(окислительно-восстановительных
систем), соединенных между собой
металлическим проводником. Полуэлемент
(иначе электрод)
чаще всего представляет собой металл,
помещенный в раствор, содержащий ионы,
способные восстанавливаться или
окисляться. Каждый электрод характеризуется
определенным значением
условного электродного потенциала
Е,
который в стандартных условиях
определяется экспериментально
относительно потенциала стандартного
водородного электрода
(СВЭ). СВЭ – это газовый электрод, который
состоит из платины, контактирующей с
газообразным водородом (Р
=
1 атм) и раствором, в котором активность
ионов водорода а
=
1 моль/дм3.
Равновесие в водородном электроде
отражается уравнением Н+
+
½ Н2.
Абсолютное
значение потенциала СВЭ неизвестно,
но условно его считают равным нулю (Е
=
0 В). Потенциалы электродов рассчитывают
по уравнению
Нернста,
которое при температуре 298 К имеет вид:
1) для металлических электродов I
рода, то есть когда металл Ме погружен
в раствор, содержащий ионы данного
металла Меn+
:
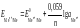 ,
где Е
,
где Е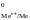 - стандартный электродный потенциал
металла, В; а
- стандартный электродный потенциал
металла, В; а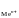 - активность ионов металла в растворе,
моль/дм3.
Значения стандартных электродных
потенциалов практически для всех
металлов определены экспериментально
и содержатся в справочной литературе.
В гальваническом элементе электрод,
имеющий меньшее значение потенциала,
называется анодом
и обозначается знаком «–». На аноде
идет окисление частиц восстановителя.
Электрод, обладающий большим потенциалом,
называется катодом
и обозначается знаком «+». На катоде
происходит восстановление частиц
окислителя. Переход электронов с
восстановителя на окислитель происходит
по металлическому проводнику, который
называют внешней
цепью.
ОВР, лежащая в основе работы гальванического
элемента, называется токообразующей
реакцией.
Основной характеристикой работы
элемента является его ЭДС Е,
которая вычисляется как разность между
потенциалами катода и анода: Е
= Екатод
– Еанод.
Поскольку потенциал катода всегда
больше потенциала анода, то из формулы
следует, что в работающем гальваническом
элементе Е
> 0. Гальванические элементы принято
записывать в виде схем, в которых одна
вертикальная линия изображает границу
раздела фаз (металл – раствор), а две
вертикальные линии – границу между
двумя растворами. На практике электрический
контакт между растворами обеспечивается
с помощью солевого
мостика
– U-образной
трубки с раствором электролита.
- активность ионов металла в растворе,
моль/дм3.
Значения стандартных электродных
потенциалов практически для всех
металлов определены экспериментально
и содержатся в справочной литературе.
В гальваническом элементе электрод,
имеющий меньшее значение потенциала,
называется анодом
и обозначается знаком «–». На аноде
идет окисление частиц восстановителя.
Электрод, обладающий большим потенциалом,
называется катодом
и обозначается знаком «+». На катоде
происходит восстановление частиц
окислителя. Переход электронов с
восстановителя на окислитель происходит
по металлическому проводнику, который
называют внешней
цепью.
ОВР, лежащая в основе работы гальванического
элемента, называется токообразующей
реакцией.
Основной характеристикой работы
элемента является его ЭДС Е,
которая вычисляется как разность между
потенциалами катода и анода: Е
= Екатод
– Еанод.
Поскольку потенциал катода всегда
больше потенциала анода, то из формулы
следует, что в работающем гальваническом
элементе Е
> 0. Гальванические элементы принято
записывать в виде схем, в которых одна
вертикальная линия изображает границу
раздела фаз (металл – раствор), а две
вертикальные линии – границу между
двумя растворами. На практике электрический
контакт между растворами обеспечивается
с помощью солевого
мостика
– U-образной
трубки с раствором электролита.
