
- •1.Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.
- •2.Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона.
- •3.Эквивалент элемента и вещества. Закон эквивалентов.
- •4. Расчет молярной массы эквивалента простого и сложного вещества.
- •2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (ао).
- •1.Свойства ковалентной связи и способы ее образования.
- •2.Основные типы гибридизации ао. Теория локализованных электронных пар.
- •4.Металлическая связь и ее свойства.
- •5.Водородная связь. Силы межмолекулярного взаимодействия.
- •2.Основы термохимии: закон Гесса и его следствия.
- •3.Тепловые эффекты процессов, термохимические уравнения.
- •4.Энтропия и ее изменение при химических реакциях.
- •5.Энергия Гиббса. Критерии определения реакционной способности
- •1.Закон действия масс для химических систем, константа химического равновесия.
- •3. Основной закон химической кинетики. Константа скорости реакции.
- •4.Кинетическая классификация реакций.
- •6.Катализаторы, каталитические системы.
- •1.Окислительно-восстановительная способность веществ. Типы овр.
- •2.Метод электронного баланса.
- •3.Метод ионно-электронных уравнений.
- •4.Эдс окислительно-восстановительного процесса, направление протекания овр.
- •5.Электродный потенциал. Условные электродные потенциалы.
- •6.Гальванические элементы. Эдс гальванического элемента.
- •7. Электролиз. Законы Фарадея.
- •8.Катодные и анодные процессы при электролизе водных растворов.
- •9.Коррозия металлов и ее виды. Показатели скорости коррозии.
- •10.Способы защиты металлов от коррозии.
- •1.Способы выражения состава растворов.
- •2.Закон Рауля для бесконечно разбавленного раствора неэлектролита.
- •3.Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •4.Замерзание и кипение бесконечно разбавленных растворов неэлектролитов.
- •5.Электролиты: современная теория диссоциации, классификация, коллигативные свойства, изотонический коэффициент.
- •6.Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.
- •7.Произведение растворимости.
- •8.Электролитическая диссоциация воды, ионное произведение воды. Водородный показатель рН, гидроксильный показатель рОн.
- •9.Ионные реакции, смещение ионного равновесия.
- •10.Гидролиз солей. Константа и степень гидролиза.
- •11.Общие понятия о дисперсных системах.
- •12.Коллоидные растворы и методы их получения.
- •13.Оптические и электрические свойства коллоидных растворов.
- •14.Коагуляция, седиментация и пептизация коллоидных растворов.
2.Метод электронного баланса.
Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений. Оба метода основаны на реализации двух принципов:
1.Принцип
материального
баланса
– число атомов всех элементов до и
после реакции должно быть одинаковым;
2. Принцип электронного
баланса
– число электронов, отданных
восстановителем, должно быть равно
числу электронов, принятых окислителем.
Метод электронного баланса является
универсальным, то есть им можно
пользоваться для уравнивания ОВР,
протекающих в любых условиях. Основные
этапы составления уравнений реакций
по методу электронного баланса:
1.Записывают
схему реакции, определяют СО элементов,
выявляют окислитель и восстановитель.
Например: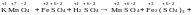 …
Очевидно, что СО изменяется у марганца
(уменьшается) и у железа (увеличивается).
Таким образом, KMnO4
– окислитель, а FeSO4
– восстановитель. 2.Составляют
полуреакции окисления и восстановления:
…
Очевидно, что СО изменяется у марганца
(уменьшается) и у железа (увеличивается).
Таким образом, KMnO4
– окислитель, а FeSO4
– восстановитель. 2.Составляют
полуреакции окисления и восстановления:
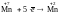 (восстановление),
(восстановление),
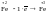 (окисление). 3.Балансируют
количество принятых и отданных электронов
путем переноса коэффициентов, стоящих
перед электронами, в виде множителей,
поменяв их местами:
(окисление). 3.Балансируют
количество принятых и отданных электронов
путем переноса коэффициентов, стоящих
перед электронами, в виде множителей,
поменяв их местами:
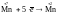
1
2,
5
10. Если коэффициенты кратны друг другу,
их следует уменьшить, поделив каждый
на наибольшее общее кратное. Если
коэффициенты нечетные, а формула хотя
бы одного вещества содержит четное
количество атомов, то коэффициенты
следует удвоить. Так, в рассматриваемом
примере коэффициенты перед электронами
нечетные (1 и 5), а формула Fe2(SO4)3
содержит два атома железа, поэтому
коэффициенты увеличиваем в два раза.
4.Записывают
суммарную реакцию электронного баланса.
При этом количество принятых и отданных
электронов должно быть одинаковым и
должно сократиться на данном этапе
уравнивания.. 5.Расставляют
коэффициенты в молекулярном уравнении
реакции и вносят недостающие вещества.
При этом коэффициенты перед веществами,
которые содержат атомы элементов
изменявших СО, берутся из суммарной
реакции электронного баланса, а атомы
остальных элементов уравнивают обычным
способом, соблюдая следующую
последовательность: – атомы металлов;
– атомы неметаллов (кроме кислорода
и водорода); – атомы водорода; – атомы
кислорода. Для рассматриваемого примера
2KMnO4
+ 10FeSO4
+ 8H2SO4
= 2MnSO4
+ 5Fe2(SO4)3
+ K2SO4
+ 8H2O.
1
2,
5
10. Если коэффициенты кратны друг другу,
их следует уменьшить, поделив каждый
на наибольшее общее кратное. Если
коэффициенты нечетные, а формула хотя
бы одного вещества содержит четное
количество атомов, то коэффициенты
следует удвоить. Так, в рассматриваемом
примере коэффициенты перед электронами
нечетные (1 и 5), а формула Fe2(SO4)3
содержит два атома железа, поэтому
коэффициенты увеличиваем в два раза.
4.Записывают
суммарную реакцию электронного баланса.
При этом количество принятых и отданных
электронов должно быть одинаковым и
должно сократиться на данном этапе
уравнивания.. 5.Расставляют
коэффициенты в молекулярном уравнении
реакции и вносят недостающие вещества.
При этом коэффициенты перед веществами,
которые содержат атомы элементов
изменявших СО, берутся из суммарной
реакции электронного баланса, а атомы
остальных элементов уравнивают обычным
способом, соблюдая следующую
последовательность: – атомы металлов;
– атомы неметаллов (кроме кислорода
и водорода); – атомы водорода; – атомы
кислорода. Для рассматриваемого примера
2KMnO4
+ 10FeSO4
+ 8H2SO4
= 2MnSO4
+ 5Fe2(SO4)3
+ K2SO4
+ 8H2O.
3.Метод ионно-электронных уравнений.
Существует
несколько способов подбора коэффициентов
в уравнениях ОВР, из которых наиболее
распространены метод
электронного баланса
и метод
ионно-электронных уравнений.
Оба метода основаны на реализации двух
принципов: 1.Принцип материального
баланса
– число атомов всех элементов до и
после реакции должно быть одинаковым;
2. Принцип электронного
баланса
– число электронов, отданных
восстановителем, должно быть равно
числу электронов, принятых окислителем.
При
уравнивании реакций методом
ионно-электронных уравнений
соблюдают следующую последовательность
действий:
1.Записывают
схему реакции, определяют СО элементов,
выявляют окислитель и восстановитель.
Например: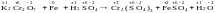 .
СО изменяется у хрома (уменьшается) и
у железа (увеличивается). Таким образом,
K2Сr2O7
– окислитель, а Fe
– восстановитель. 2.Записывают
ионную схему реакции. При этом сильные
электролиты записываются в виде ионов,
а слабые электролиты, нерастворимые и
малорастворимые вещества, а также газы
оставляют в молекулярном виде. Для
рассматриваемого процесса K+
+ Cr2O72-+
Fe
+ H+
+ SO42-
Cr3+
+ SO42-+
Fe2+
+ H2O.
3.Составляют уравнения ионных полуреакций.
Для этого сначала уравнивают количество
частиц, содержащих атомы элементов,
изменявших свои СО: Cr2O72-
2Cr3+,
Fe
Fe2+.
Далее уравнивают кислород и водород,
используя: а) в кислых средах Н2О
и (или) Н+;
б) в нейтральных средах Н2О
и Н+
(или Н2О
и ОН-);
в) в щелочных средах Н2О
и (или) ОН-.
Cr2O72-
+
14Н+
2Cr3+
+ 7Н2О,
Fe
Fe2+.
Затем уравнивают заряды с помощью
прибавления или отнятия определенного
количества электронов: [Cr2O72
+
14Н+]12+
+ 6
ē
[2Cr3+
+ 7Н2О]6+,
Fe0
– 2
ē
Fe2+.
4.Балансируют
количество принятых и отданных электронов
так, как это описано в методе электронного
баланса [Cr2O72-
+
14Н+]12+
+ 6
ē
[2Cr3+
+ 7Н2О]6+
21,
Fe0
– 2
ē
Fe2+
63.
5.Записывают
суммарную реакцию ионно-электронного
баланса: Cr2O72-
+
14H+
+ 6
ē
+ 3Fe
– 6
ē
2Cr3+
+ 7H2O
+ 3Fe2+.
6.Расставляют
коэффициенты в молекулярном уравнении
реакции: K2Cr2O7
+ 3Fe
+ 7H2SO4
= Cr2(SO4)3
+ 3FeSO4
+ K2SO4
+ 7H2O.
.
СО изменяется у хрома (уменьшается) и
у железа (увеличивается). Таким образом,
K2Сr2O7
– окислитель, а Fe
– восстановитель. 2.Записывают
ионную схему реакции. При этом сильные
электролиты записываются в виде ионов,
а слабые электролиты, нерастворимые и
малорастворимые вещества, а также газы
оставляют в молекулярном виде. Для
рассматриваемого процесса K+
+ Cr2O72-+
Fe
+ H+
+ SO42-
Cr3+
+ SO42-+
Fe2+
+ H2O.
3.Составляют уравнения ионных полуреакций.
Для этого сначала уравнивают количество
частиц, содержащих атомы элементов,
изменявших свои СО: Cr2O72-
2Cr3+,
Fe
Fe2+.
Далее уравнивают кислород и водород,
используя: а) в кислых средах Н2О
и (или) Н+;
б) в нейтральных средах Н2О
и Н+
(или Н2О
и ОН-);
в) в щелочных средах Н2О
и (или) ОН-.
Cr2O72-
+
14Н+
2Cr3+
+ 7Н2О,
Fe
Fe2+.
Затем уравнивают заряды с помощью
прибавления или отнятия определенного
количества электронов: [Cr2O72
+
14Н+]12+
+ 6
ē
[2Cr3+
+ 7Н2О]6+,
Fe0
– 2
ē
Fe2+.
4.Балансируют
количество принятых и отданных электронов
так, как это описано в методе электронного
баланса [Cr2O72-
+
14Н+]12+
+ 6
ē
[2Cr3+
+ 7Н2О]6+
21,
Fe0
– 2
ē
Fe2+
63.
5.Записывают
суммарную реакцию ионно-электронного
баланса: Cr2O72-
+
14H+
+ 6
ē
+ 3Fe
– 6
ē
2Cr3+
+ 7H2O
+ 3Fe2+.
6.Расставляют
коэффициенты в молекулярном уравнении
реакции: K2Cr2O7
+ 3Fe
+ 7H2SO4
= Cr2(SO4)3
+ 3FeSO4
+ K2SO4
+ 7H2O.
