
- •Теоретические основы неорганической химии Лекция 1. Основные понятия химии
- •Лекция 2. Основные стехиометрические законы
- •Лекция 3. Важнейшие классы и номенлатура неорганических соединений
- •Лекция 4. Развитие учения о строении атомов
- •Лекция 5. Строение электронных оболочек атома и периодический закон д.И. Менделеева
- •Для энергетической характеристики электрона в атоме необходимо указать значения четырех квантовых чисел: главного, побочного, магнитного и спинового квантовых чисел. Разберем их в отдельности.
- •Электроны в атоме распределяются в соответствии со значениями их четырех квантовых чисел и с учетом следующих правил (или принципов):
- •Лекция 6. Периодическая система элементов и электронная структура
- •Эффективные радиусы атомов, ǻ 1,27 1,39 1,40
- •Орбитальные и эффективные радиусы некоторых атомов и ионов
- •Лекция 7. Природа химической связи и строение химических соединений
- •Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства.
- •Лекция 8. Химическая связь. Метод молекулярных орбиталей
- •Лекция 10. Энергетика и направление химических реакций
- •Так как g298 реакции 0, то при 298к данная реакция возможна в прямом направлении. Лекция 11. Скорость химических реакций
- •Лекция 12. Химическое равновесие
- •Смещается вправо (), а при понижении давления влево ().
- •Лекция 13. Агрегатные состояния вещества. Многокомпонентные системы. Растворы
- •Лекция 14. Свойства растворов неэлектролитов
- •Лекция 15. Слабые и сильные электролиты
- •Лекция 16. Диссоциация электролитов
- •Интервал перехода и изменение окраски индикаторов
- •Лекция 17. Гидролиз солей. Степень и константа гидролиза
- •Лекция 18. Реакции с переносом электронов или окислительно-восстановительные реакции
- •Лекция 19. Комплексные соединения. Устойчивость комплексных соединений
- •2. Диссоциация комплексных соединений. Константа образования и нестойкости комплексов
- •3. Природа химической связи в комплексных соединениях
- •Биологическая роль и применение комплексных соединений.
- •Лекция 20. Природа химической связи и изомерия в комплексных соединениях
- •246019, Г. Гомель, ул. Советская, 104
Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства.
Насыщаемость ковалентной связи – это есть число ковалентных связей, которые способен образовать данный атом с другими атомами. Она определяется природой атома и его валентной структурой. Благодаря насыщаемости связи молекулы имеют определенный состав (Н2О, НСl, H3N, H2S и др.).
Разберем это свойство для некоторых атомов.
Возьмем атом водорода Н, у которого на 1S-орбитали находится один неспаренный валентный электрон (↑), за счет которого атом Н может образовать одну ковалентную связь, т.е. ковалентность будет равна 1
(Н –Н, Н – Сl).
Возьмем атом углерода. Его электронная формула 1s22s22p2, а электронно-структурная схема валентного уровня будет:
│ ↑ │ ↑ │ │
│↑↓│ 2р
2s
т.е. имеет 2 неспаренных электрона, за счет которых может образовать 2 ковалентные связи. Но для углерода (С) характерно образование четырех ковалентных связей. Поэтому атом «С» переходит в возбужденное состояние, т.е. один из двух 2s-электронов переходит на свободную орбиталь 2р-подуровня и тогда станет 4 неспаренных электрона, за счет которых атом С может образовать 4 ковалентные связи, т.е. ковалентность будет равна 4 (СН4, СО2 и др.).
│ ↑ │ ↑ │ │ возбуждение │ ↑ │ ↑ │ ↑ │
 │↑↓│ │
↑ │ 2р
│↑↓│ │
↑ │ 2р
2s 2s
Таким образом, максимальная ковалентность атома углерода равна числу валентных орбителей и равна 4.
Возьмем атом азота, у которого на 4 валентных орбиталях находятся 5 валентных электрона, три из которых неспаренные:
│ ↑ │ ↑ │ ↑ │
│↑↓│ 2р
2s
За счет трех неспаренных электронов атом N образует 3 ковалентные связи с тремя атомами водорода, у которых по одному неспаренному электрону, при этом образуется молекула NH3:
 N
│ ↑ │ ↑ │ ↑ │
N
│ ↑ │ ↑ │ ↑ │
│↑↓│ NH3
│ ↓ │ ↓ │ ↓ │
Н Н Н
Кроме того, у атома N осталась еще неподеленная электронная пара, поэтому за счет этой пары электронов азот может образовать с ионом Н+ еще одну (четвертую) ковалентную связь. При этом на образование этой связи атом азота отдаст два электрона (электронную пару), а ион водорода (□Н+) примет эту пару электронов на свою свободную валентную орбиталь. Такая ковалентная связь называется донорно-акцепторной связью, причем азот будет называться донором электронной пары, а ион Н+ называется акцептором электронной пары.
Таким образом, атом N в итоге образовал 4 ковалентные связи: три из них за счет 3 неспаренных электронов и одну связь - по донорно-акцепторному механизму.
 │ ↑ │ ↑ │ ↑ │ В
итоге получили ион аммония
│ ↑ │ ↑ │ ↑ │ В
итоге получили ион аммония
│↑↓│ NH+4, в котором ковалентность
NH+4 ↓ азота равна 4.
│ ││ ↓ │ ↓ │ ↓ │
Н+ Н Н Н
Таким образом, максимальная ковалентность атома азота равна числу его валентных орбиталей и равна 4.
Ковалентная связь обладает свойством направленности. Орбитали р- и d-типа направлены по координатным осям. В соответствии с направленностью атомных орбиталей происходит и их перекрывание при образовании ковалентной связи, поэтому и ковалентная связь обладает свойством направленности.
Пример 1. Н – Сl При образовании молекулы НСl образуется ковалентнаясвязь при перекрывании s-электронного облака атома Н и р - электронного облака атома хлора, образуется линейная молекула:
Пример 2. Рассмотрим молекулу Н2S. У атома серы два неспаренных р-электрона. В молекуле Н2S образуется две σ - связи за счет перекрывания р-орбиталей атома серы, на которых расположены неспаренные электроны, с s – электронными облаками двух атомов Н. Так как р-орбитали атома серы расположены под углом 90о относительно друг друга, то и валентный угол (это угол между двумя ковалентными связями) тоже должен быть равен 90о. Однако он равен 92о. Это можно объяснить отталкиванием одноименных зарядов δ+ двух атомов Н (т.к. связь S-Н полярна), поэтому валентный угол увеличивается с 90о до 92о. Направленность ковалентной связи зависит также от типа гибридизации валентных орбиталей атома (см. ниже).
3. Гибридизация атомных орбиталей.
Гибридизация – это процесс смешивания (сложения) различных по форме и энергии атомных орбиталей с образованием такого же количества новых, но уже одинаковых по форме и энергии гибридных орбиталей. Гибридная орбиталь имеет большую вытянутость по одну сторону от ядра, чем по другую, поэтому степень ее перекрывания с орбиталью другого атома больше, а значит гибридная орбиталь образует более прочную связь по сравнению с негибридными орбиталями.
Существуют следующие типы гибридизации:
sp – гибридизация орбиталей – это гибридизация (смешивание) одной s- и одной р-орбитали, при этом образуются две sp – гибридные орбитали, расположенные симметрично под углом 180о. Поэтому и связи, образуемые с участием этих орбиталей, тоже располагаются под углом 180о. Например, sр-гибридизация орбиталей наблюдается у атома бериллия в молекуле ВеCl2, поэтому эта молекула имеет линейную форму:
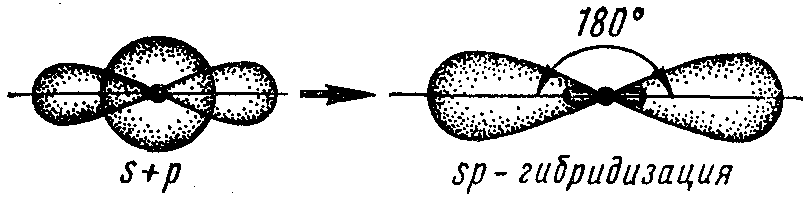
![]()
sр2- гибридизация – это смешивание одной s-орбитали и двух р-орбиталей с образованием трех одинаковых sp2-гибридных орбиталей, расположенных под углом120о относительно друг друга:
Например, sp2-гибридизация валентных орбиталей атома бора в молекуле ВСl3, поэтому эта молекула имеет форму треугольника:
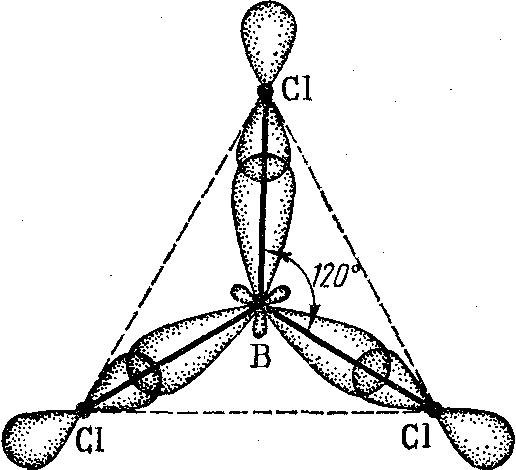
sр3-гибридизация – это смешивание одной s– и трех р–орбиталей с образованием четырех гибридных sp3-орбиталей, причем эти гибридные орбитали направлены к четырем вершинам тетраэдра под углом 109о28΄ (сто девять градусов двадцать восемь минут). Такая гибридизация наблюдается в молекулах ССl4, СН4 и др.

Если
химическая связь образуется между
атомами равных размеров и одинаковой
электроотрицательностью, то образуется
неполярная ковалентная связь ( Н : Н,![]() ).
Если электроотрицательности атомов
различны, но не сильно отличаются друг
от друга, то происходит смещение
электронной плотности (общей электронной
пары) к более электроотрицательному
атому и образуется полярная ковалентная
связь, например в НСl.
Нδ+
–
Сlδ-.
).
Если электроотрицательности атомов
различны, но не сильно отличаются друг
от друга, то происходит смещение
электронной плотности (общей электронной
пары) к более электроотрицательному
атому и образуется полярная ковалентная
связь, например в НСl.
Нδ+
–
Сlδ-.
Полярность связи количественно выражается дипольным моментом μ = l ∙ q, где μ – дипольный момент связи, l – длина связи, q –абсолютная величина эффективного заряда атома. Дипольный момент выражается в единицах Дебая (Д) или в системе СИ в Кл ∙ м (кулон ∙ метр). μ(НСl) = 1,08 Д или 0,347 ∙ 10-29Кл м. Чем больше значение μ, тем связь более полярная. Дипольный момент связи зависит от разности электроотрицательностей двух атомов, образующих между собой связь.
Поляризуемость связи – это есть способность ковалентной связи поляризоваться (деформироваться) в результате действия на молекулу внешнего электрического поля (или при действии иона и полярной молекулы). При этом неполярная связь становится полярной, а полярная связь становится более полярной. Поляризуемость связи зависит от заряда атомов, образующих связь, от размера атомов и формы орбиталей.
Эффективный заряд атома – это заряд, который возникает на атомах при образовании химической связи между ними вследствие смещения электронной плотности (общей электронной пары) к атому более электроотрицательного элемента Нδ+ - Сlδ-. Согласно опытным данным эффективный (реальный) заряд на атоме водорода составляет δ+ = + 0,18, а на атоме хлора составляет δ- = -0,18 заряда электрона, т.е. связь в молекуле НСl имеет на 18% ионный характер, а на 82% - ковалентный характер (т.е. в НСl ковалентная полярная связь). Чем больше разность электроотрицательностей двух связанных атомов, тем больше на них возникает эффективный заряд.
