3. Реакции полимеризации
Этилен. Получают из природного газа или в процессе нефтепереработки дегидрированием этана. Применяется как сырье в органическом синтезе.
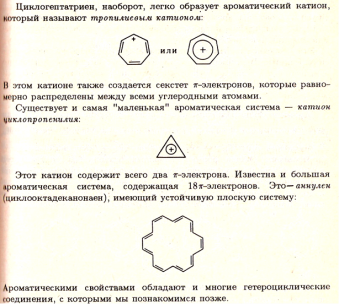
Алкены могут существовать в виде геометрических изомеров.Поскольку фрагменты молекулы алкена не имеют возможности вращаться относительно двойной связи, заместители у углеродных атомов при этой связи могут располагаться как по одну, так и по разные стороны. Стереоизомеры, различающиеся расположением заместителей относительно двойной связи, называют геометрическими изомерами. Для обозначения геометрических изомеров применяют две номенклатуры: цис-, транс- и E,Z-.В соответствии с цис-, транс-номенклатурой геометрические изомеры. В которых заместители расположены по одну сторону относительно двойной связи, называют цис-изомерами. Геометрические изомеры, в которых заместители расположены по разные стороны относительно двойной связи, называют транс-изомеры. Также для алкенов характерна изомерия положения двойной связи
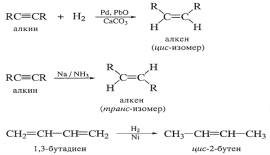
Дегидрирование алканов служит основным источником алкенов в промышленности. В качестве катализатора применяют триоксид хрома.
Процесс проводят при высокой температуре (до 4500С):
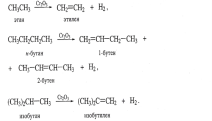
Крекинг алканов проводят при более высокой температуре. Этот процесс протекает менее однозначно:
![]()
Галогенирование алкенов проводят в присутствии инициаторов радикальных реакций: для этого применяют четыреххлористый углерод или хлороформ:
CH2=CH2 + Br2 CH2- CH2
Br Br
Правила Марковникова: при присоединении к несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному (имеющему большее число атомов водорода) атому углерода.
Гидратация:
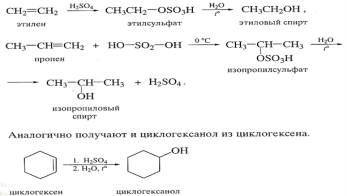
Гидратация алкенов сложного строения под действием разбавленных минеральных кислот. Гидратация разветвленных алкенов сопровождается перегруппировками:
![]()
Присоединение спиртов к алкенам идет аналогично гидратации в присутствии минеральных кислот. Продуктом реакции является простой эфир.

Этот процесс протекает ступенчато- с образованием последовательно моно- ди- и триалкилборанов.
![]()
Эпоксидирование.
Образование эпоксида (циклического простого эфира) при действии пероксикарбоновой кислоты (или надкислоты) на алкен называют эпоксидированием (реакция Прилежаева). Перокикарбоновые кислоты отличаются от кислот тем, что аналогично пероксиду водорода содкржат простую О-О-связь
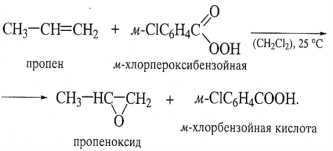
Ароматические(Бензол) Молекулярн. ф-ла – C6H6-бензол Хим. Св-ва бензола I. Горения:
1).2C6H6+15O2=12CO2+6H2O+Q 2).Бензол устойчив к окисл., не вступает в р-цию, но его гамологи окисл. легче. (Окисление идет по радикалу). C6H5-CH3+3O2=C6H5-COH +H2O II. Замещения.
3). Галогенирование C6H6+Br2=C6H5Br+HBr 4). Нитрирование – C6H6+HONO2=C6H5NO2+H2O III. Присоединения;
5). Гидрирование C6H6+3H2=C6H12 6).Хлорирование – C6H6+3Cl2=C6H6Cl6 Бензол занимает промежут. положение между пред. и непред. у/в проявляя особые св-ва. Р. Замещения протекает легче, чем у пред. у/в, а р. присоед. – труднее, чем у непред.. Это связано с особен-ю циклического строен. бензола. Получение. Выделяют из природных источников: камен. Уголь, нефть. Применение.
1. В качестве растворителя 2. Для получения нитробензола 3. Для получения хлорбензола 4. В с/х как инсектицид 5. Для пол. Стирола, из которого пол. бензол 6. Для улучшения качеств моторного топлива 7. Для пол. лекарственных и душистых средств. Бензол.CnH2n-6.сильно ненасыщенный. Имеется бензольное кольцо или ядро,относится к ар.угл.Длина C—C связи равна 0,14нм. =120.sp2-гибридизация.Делокализованные p-эл.облака.C6H6-бензол.
C6H6 + 3H2—кат=.циклогексан.
C6H5-фенилрадикал
.Получение:
1) циклогексан—Pt или Pd,300C=бензол + 3H2.
2) метилциклогексан—Pt,300C=толуол + 3H2.
3) CH3—CH2—CH2—CH2—CH2—CH3 —Pt,300C=бензол + 4H2.
4) n*H3CCH3—C,450-500C=бензол(метод Зелинского).
Физ.свойства:бензол-бесцветная, нераст.в воде жидкость со странным запахом.tкип.=80,1C.При охлаждении превращ.в белую кр.массу с tпл.=5,5C.
Хим.свойства:
реакции замещения.
1. C6H6 + Br2—FeCl3,t =C6H5Br + HBr(аналогично бензол реагирует с хлором).
2. C6H6 + HONO2—H2SO4,t =C6H5NO2(нитробензол) + H2O.
3. n*метилбензол + HONO2—H2SO4 =1-метил-2,4,6-тринитробензол + H2O(легче).
Реакции окисления:бензол очень стоек.Окисляются только боковые цепи.
C6H5—CH3 + 3O2=C6H5—CОOH(бензойная кислота) + H2O(KMnO4).
Взаимное влияние ядра и метильной группы друг на друга.
2C6H6 + 15O2=12CO2 + 6H2O(коптящее пламя).
Реакции присоединения:при действии h и ультр.л.
C6H6 + 3Cl2—h=гексахлорциклогексан.
C6H6 + 3H2—t,кат.=циклогексан(р.гидрирования).
n*CH2=CH2 =n*(--CH2—CH--)(полимеризация стирола).
Применение:бензол-получение красителей,медикаментов,вз.вещ-в,средств защиты растений, пластмасс,синт.волокон.Растворитель орг.вещ-в.Толуол исп.для получения красителей и тринитротолуола.
C6Cl6(гексахлорбензол)-протравка семян. Пестициды.Инсектициды-насекомые.Гербициды-сорняки.Фунгициды-гр.заб.
C6H5—OH пластмассы,красители,лекарства.
C6H5—CH=CH2-пластмассы,бутадиенстирольный каучук.
C6H5—CH3-красители,вз.вещ-ва,сахарин,растворители.
C6H5-NO2анилин,растворители. Ксилолы-волокна лавсана.
Природные источники угл. и их переработка.Наиболее важные-природные и попутные нефтяные газы,нефть,каменный уголь.
Согласно формуле Кекуле, бензол- замкнутая система с тремя сопряженными двойными связями (циклогексатриен-1,3,5). Эта формула отражает правильно элементный состав и равноценность всех водородных связей. Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой. В одной плоскости с кольцом лежат и шесть связей С-Н, каждая из которых образует с ребром шестиугольника угол, равный 1200С. Каждый углеродный атом в молекуле находится в sp2-гибридизации. Для ароматических соединений характерно также определенное число π-электронов. Немецкий химик-теоретик Э.Хюккель вывел правило (1931г): плоские циклические соединения, имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих электронов равно 4n+2 (где n-=0,1,2,3 и т.д.).