
Способы получения
1. Дегидрогенизация и крекинг предельных углеводородов (промышленные методы получения) Дегидрирование (дегидрогенизация) - отщепление водорода происходит под действием более высокой температуры, чем крекинг.
C4H10=СН3-СН=СН-СН3+H2 .
2. Элюирование спиртов
СН3-СН2-ОН+Н2SO4=
CH3-CH2-OSO3H+H2O
3.Дегидрогалогенирование галогеналканов:
CH3-CH2-CHBr-CH3=
CH3-CH2-CH=CH2+HCCH3=HCCH3 +HCCH3=CH3CH. Эти реакции сопровождаются регионселективностью-это реакции,в ходе которых хим. Превращения подвергается преимущественно одно из 2-х или нескольких положений молекулы субстрата. Эти реакции протекают согласно правила Зайцева: водород отщепляется от наменее гидрированного из двух соседних с галогеносодержащим атомов углерода, т.к. термодинамически более устойчивы олефины, у которых непредельные атомы углерода связаны с алкилами, а не с водородом.
4. Отщепление 2-х атомов галогена от вицинальных дигалогенопроизводных углеводородов.
СH2-CH2 + Zn ZnBr2 + CH2 Br=CH2 Br
5. Частичное гидрирование ацетиленовых углеводородов
CH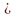 CH
+ H2
CH
+ H2
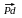 CH2=CH2
CH2=CH2
Олефины с углеродной цепью С2 – С4 – газ; С5 – С16 – жидкости; С17 и более – твердые вещества.
Химические свойства1. Реакции присоединения
1. Присоединение водорода происходит при действии молекулярного водорода СН2=СН2 + Н2 = Ni, Pt, Pd СН3-СН3
2. Присоединение галогенов.
F2 – присоединяется со взрывом;
Cl – на рассеянном свету или при низкой температуре в присутствии катализатора FeCl3;
Br2 – при комнатной температуре в полярных растворителях;
I – медленно в полярных растворителях.
Эффект Караша
Присоединение галогеноводородов в присутствии примесей перекисей происходит не по правилу Марковникова:если алкен несимметричен при присоединению к несимметричному алкену протон присоединяется к наиболее гидротированому аниону углерода . Причина – свободнорадикальный механизм реакции.
HO : OH 2HO
HO. + HBr H2O + Br
Br. + CH2=CH-CH3 CH2Br-CH.-CH3(1) CH2.-CHBr-CH3 (2)
Более
устойчив (1) и образуется преимущественно,
т.к. свободный электрон сопряжен с
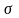 -электронами
пяти С-Н связей.
-электронами
пяти С-Н связей.
СH2Br-CH.-CH3 + HBr CH2Br-CH2-CH3 + Br
Электрофильные реакции протекают через промежуточное образование карбкатионов, поэтому рассмотрим их свойства.
2. Реакции окисления
Благодаря легкости разрыва -связи олефины хорошо окисляются. Различаются следующие виды реакций окисления:
1. С разрывом только -связи.
а) окисление по Вагнеру – действие разбавленного водного раствора KMnO4 при комнатной температуре – приводит к образованию гликолей
СH2=CH2 + O CH2-CH2 + HOH
C-C=C + KMnO4=C-COH-COH,при этой реакции образуются диолы.
C-C=C+KMnO4=C-COOH+CO2+H2O, жесткое окисление.
2. Озонирование – окисление озоном О3.
При действии озона сначала происходит его присоединение по двойной связи с образованием озонидов.
C-C=C+O3=C-COOH+
H-COOHH2OCO2
