

Лекция №1
Группа веществ, изолируемых из биологических объектов минерализацией («металлические яды»)
Слайд 1
Группа тяжёлых металлов (ТМ)
1) Sn, Hg, Bi, Cu, Cd, Pb, Ag,
Zn, Cr, Mn, Tl, Ni, Co, Ba и др.
Металлические свойства ρ>5 г/см3

2) As, Sb и др. Некоторые металлические свойства
(электропроводность)
Таблица 1. Содержание металлов в организме человека (микроэлементы)
Элемент |
Содержание (весовые %) |
Тип элемента |
Fe Zn Cu |
5×10-3 3×10-3 1×10-4 |
Главные энзим-образующие |
Mn Ni Cr Co |
2×10-5 4×10-5 4×10-5 2×10-5 |
Более редкие энзим-образователи |
Слайд 2
Минерализация (разрушение) необходима в связи со способностью ТМ образовывать прочные соединения с белками, без деструкции ко- торых ТМ не могут быть обнаружены.
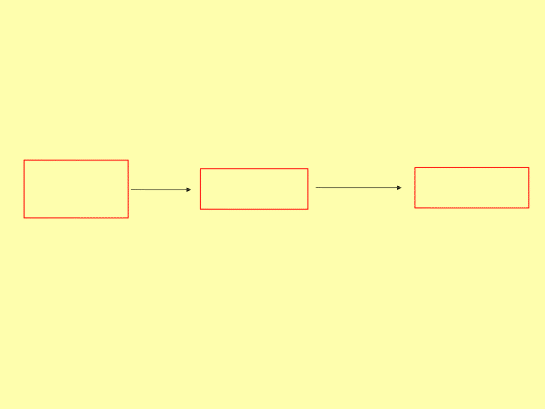 Сложные
белковые
комплексы
ТМ
Сложные
белковые
комплексы
ТМ
минерали- зация
Более простые соединения ТМ
дальнейшие преобразования
Обнаружение и определение ТМ
Слайд 3
Мышьяк
As
«яд Борджиа»
Александр VI Цезарь Борджиа
 Наполеон
Бонапарт Гилберт
Кит
Честертон
Наполеон
Бонапарт Гилберт
Кит
Честертон
Слайд 4
Распространённые источники отравления некоторыми тяжелыми металлами
Hg ртутная мазь от педикулёза
гранозан (этилмеркурхлорид C2H5HgCl, обработка подсолнечника)
СССР, 1924-1925 гг. – 963 смертельных исхода отравления сулемой (HgCl2)
Cu отравления в районах садоводства и виноделия (CuSO4·5H2O)
Tl отравления после обработки зерна (увеличение всхожести)
Pb добавки к краскам (красящие вещества, стабилизаторы) США – страдают 200 000 детей ежегодно
Летальность при отравлениях тяжелыми металлами
64-85% 15-19%
средние века
при современных методах лечения

Слайд 5
Соединения мышьяка
1) Неорганические соединения As
As2O3 мышьяковистый ангидрид, белый мышьяк
As2O3 мышьяковый ангидрид
NaAsO2 арсенит натрия
AsH3 мышьяковистый водород арсин
2) Органические соединения As
инцектициды (борьба с грызунами) фунгициды (противогрибковое действие) гербициды (борьба с сорняками) растворы стекольного производства
отравления при плавке металлов, гальванизации, травлении, ковке, при производстве микрочипов
Присутствуют в окружающей среде (ОС)
Применение в медицине: лечение больных сифилисом, эпилепсией, псориазом и амебиазом
в зубоврачебной практике
(некротизирующее действие)
в прошлом
Отравление:
1) Острое: несчастный случай на производстве, самоубийство, убийство
2) Хроническое: воздействие малыми дозами на производствах, хроническое
 употребление
загрязненной
пищи,
воды,
лекарств
употребление
загрязненной
пищи,
воды,
лекарств
Слайд 6
Соединения кадмия
Источники производства, загрязненный воздух в шахтах
отравления плавка металлов, легкоплавкие сплавы гальванические элементы, электрогальванизация пигмент в красках и пластмассах
замена висмута в типографском шрифте
замена олова при эмалировании посуды
CdS компонент светящихся красок
(роспись на фарфоре) CdSO4 приготовление красок растворимые лаборатоные реактивы соединения
Накопление:
в панцирях и раковинах животных, водорослях
Cd производство
Пути отравления:
дыхание
кислоты во
кадмиевая
CdO
сплавов (to) пары
организм
фруктовых соках, образование солей Cd
эмаль посуды
 промышленный бытовой
промышленный бытовой
Слайд 7
Соединения свинца
Отравления распространены со времен промышленной революции. С 1870 г. соли свинца добавляют к краскам.
PbCO3 свинцовые белила
PbCrO4 краски
PbHAsO4 инсектицид, фунгицид
PbO свинцовый пластырь
2% массы земной коры
стеарат свинца олеат свинца
стабилизаторы пластмасс сиккативные добавки к краскам помады и средства для волос

Пути отравления:
1) Промышленный (отравление парами и вдыхаемой пылью)
2) Бытовой (консервы в недоброкачественной посуде – эмаль, лужение)
Слайд 8
 Соединения
ртути
Соединения
ртути
Источники ртути:
1) Неорганические (элементарная ртуть и соли ртути)
2) Органические (метилированная ртуть)
Форма |
Применение |
Пути преобразования |
Токсическое действие |
Hg |
сфигмоманометры, термометры, смеси для пломбирования зубов |
легко испаряется, окисляется на воздухе до Hg(II) |
при вдыхании паров |
Соли Hg(II) |
ЛС местного примене- ния, слабительные, катализаторы в произ- водстве пластмасс |
легко метилируется бактериями |
при попадании в желудочно- кишечный тракт |
Органичес- кие произ- водные |
краски, фунгициды, медикаменты, косметика |
|
Минамата-Бэй (Япония) – массовые отравления рыбой (1940-1950 гг.)
Слайд 9
Соединения таллия
Применение: инсектициды
для борьбы с грызунами в фейерверках компонент сплавов
в радиологических исследованиях
Форма: TlJ, Tl2SO4, TlNO3
Массовые отравления: зерно, обработанное соединениями таллия
Слайд 10
Общие токсикологические сведения
Пути поступления : перорально
в организм ингаляционно парэнтерально
Участки всасывания: двенадцатиперстная кишка начальный отдел тонкой кишки
Накопление: во всех органах
в больших концентрациях – в почках и печени
(металлотионин, содержит группы SH)
Выделение: почки, печень
желудочно-кишечный тракт потовые и слюнные железы
Слайд 11
Общие токсикологические сведения
Токсичность возрастает с увеличением атомного веса металла, зависит от способности к диссоциации их комплексов с белками, от растворимости соединений в воде и липидах. Более медленная ионизация оксидов делает их менее токсичными, чем соли тех же металлов.
-
Соединения
Смертельная доза, г
Соединения Hg
0.5
Каломель
1-2
Медный купорос
10
Ацетат свинца
50
Свинцовые белила
20
Бихромат калия
3-8
Мышьяк
0.1-0.2
ПДК для AsH3
в воздухе 0.3 мг/м3
Слайд 12
