
- •1.Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
- •2.Аминокислоты,входящие в состав белков,их строение и свойства. Пептидная связь. Первичная структура белков. Зависимость биологических свойств от первичной структкры.
- •4. Четвертичная стуктурабелков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков и их денатурация.
- •6.Многообразие белков. Глобулярные и фибриллярные белки.
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •22.Строение нуклеиновых кислот. Связи, формирующие структуру днк, рнк. Строение хроматина и рибосом.
- •25 Транскрипция
- •26. Трансляция
- •27. Свойства биологического кода.
- •28. Теория оперона. Функционирование оперонов, регулируемых по механизму индукции и репрессии.
- •29. Молекулярные механизмы генетической изменчивости. Молекулярные мутации: замены,делеции,вставки нуклеотидов
- •30.Основные пищевые вещества-углеводы, жиры, белки,суточная потребность.
- •31. Незаменимые аминокислоты: пищевая ценность разных белков
- •32. Витамины. Классификация витаминов.
- •1. Витамины, растворимые в жирах
- •3. Витаминоподобные в вещества
- •33.Функции витаминов. Алиментарные и вторичные авитаминозы гиповитаминозы. Гипервитаминоз.
- •34. Витаминзависимые и витаминрезистентные состояния.
- •35. Биохимическая характеристика патогенеза рахита
- •36. Биохимическая характеристика гипервитаминозов а и д
- •37. Понятие о метаболизме,метаболических путях. Ферменты и метаболизм. Понятие регуляции метаболизма.
- •39.Основные мембраны клетки и их функции. Общие свойства мембран:жидкостность, поперечная ассиметрия, избирательная проницаемость
- •40. Липидный состав мембран- фосфолипиды, гликолипиды, холестерин.
- •41. Роль липидов в формировании бислоя.
- •42. Участие фосфолипаз в обмене фосфолипидов.
- •43. Белки мембран: интегральные, поверхностные, заякоренные.
- •46. Эндэргонические и экзэргоническиг реакции в живой клетке. Макроэргические соединения.
- •50. Окислительное фосфорилирование, коэффициент p/о.
- •51. Строение митохондрий и структурная организация дыхательной цепи.
- •52. Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторные функции тканевого дыхания.
- •53. Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипоавитаминоза и др. Причин.
- •55. Цикл лимонной кислоты.
- •56.Механизмы регуляции цитратного цикла
- •57 Основные углеводы животных,их содержание в тканях, биологическая роль. Основные углеводы пищи. Преваривание углеводов.
- •58.Глюкоза как важн. Метаболит углеводного обмена:общая схема источников и путей расходования глюкозы в организма.
- •59. Катаболизм глюкозы. Аэробный распад
- •60Распространение и физиологическое значение аэробного распада глюкозы.
- •62Аэробный распад глюкозы.Гликолитическая оксидоредукция
- •63. Распространение и физ значение анаэробного распада глюкозы
- •64.Биосинтез глюкозы.
- •65. Цикл Кори
- •66. Представление о пентозофосфатном пути превращения глюкозы
- •70.Роль инсулина ,глюкагона,адреналина в обмене ув
- •73.Важнейшие липиды тканей человека. Резервные липиды и липиды мембран.
- •74.Жирные кислоты липидов тканей человека.
- •75.Эссенциальные жирные кислоты:омега6,3-кислоты как предшественники синтеза эйкозаноидов.
- •76. Биосинтез жирных кислот.
- •78.Биосинтез и использование кетоновых тел в качестве источника энергии
- •80.Ресинтез трацилглицеридов в стенке кишечника. Образование хиломикронов. Транспорт жиров.
- •82.Состав и строение транспортных липопротеидов крови
- •83.Депонирование и мобилизация жиров: регуляция синтеза и мобилизация жиров. Роль инсулина ,глюкагона и адреналина.
- •84.Основные фосфолипиды и гликолипиды тканей человека. Глицерофосфолипиды.
- •85.Обмен стероидов. Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина
- •86. Выведение желчных кислот и холестерина из организма
- •104.Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов.
- •105. Механизмы передачи гормональных сигналов в клетке.
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •106. Классификация гормонов по биологическому строению и биологическим функциям.
- •107.Изменение гормонального статуса и метаболизма при сахарном диабете.
- •108. Патогенез основных симптомов сахарного диабета
- •109. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина.
- •110.Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии.
- •111.Роль гормонов в регуляции обменов кальция и фосфатов.
- •112. Причины и проявления рахита, гипо и гиперпаратироидизма.
- •113. Изменение метаболизма при гипо и гипертиреозе.
- •114. Половые гормоны: строение,влияние на обмен веществ.
- •115.Распад гема
- •116.Нарушение обмена билирубина
- •117.Диагностическое значение определения билирубина
- •118.Токсичность кислорода:образование активных форм
- •119. Повреждение мембран в результате перекисного окисления липидов.
- •120.Полиморфные формы гемоглобина
- •122.Распад Гемма.Обезвреживание билирубина
- •Этапы метаболизма билирубина в организме
- •Превращение в кишечнике
- •123.Нарушение обмена билирубина:желтухи
- •124.Основные свойства белковых фракций крови и значение их определения для диагностики заболеваний. Энзимодиагностика.
- •125. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры.
- •127.Гликозаминогликаны и протеогликаны. Строение и функции.
- •128. Особенности энергетического обмена в мышцах. Креатинфосфат.
- •130.Медиаторы:катехоламины,серотонин,гамма-аминомасляная кислота,глутаминовая кислота,глицин,гистамин.
Строение и функции белков.
1.Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот. Белки – основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%)
Микроорганизмы обычно богаче белком. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например , процессы обмена веществ ( пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов , являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц, опорные ткани, покровы, состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества.
Энгельс определил, что жизнь есть способ существования белковых тел, заключающийся в постоянном самообновлении химических составных частей этих тел.
В природе существует примерно 1010-1012 различных белков. Белками являются ферменты, антитела, многие гормоны и другие биологические активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно поэтому белки и явились тем исключительным материалом , который послужил основой возникновения жизни на Земле. Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки.
Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-23% кислорода , 15-17% азота , 6-7% водорода , 0,3-2,5% серы . В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
2.Аминокислоты,входящие в состав белков,их строение и свойства. Пептидная связь. Первичная структура белков. Зависимость биологических свойств от первичной структкры.
Аминокислоты — органические кислоты, у которых атом водорода -углеродного атома замещен на аминогруппу –NH2
1.В составе белков 20 альфа-а-т,общая формула кот:
![]()
2.А-ты различаются по строению,размерам,св-м радикалов,присоединенных к альфа углеродному атому.Функц. группы а-т определяют особенности св-в разных альфа а-т:
-анионные гр-пы –СОО; катионные гр-пы –NH3,=NH, -NH-C=NH2
/ /
NH2
-полярные незаряженные гр-пы: -ОН, -CONH2, -SH; неполярные : -СН3; алифатические цепи,ароматические циклы
Пролин в отличие от других 19 мономеров белков иминокислота,радикал в пролине связан как с альфа углеродным атомом,так и с аминогруппой.
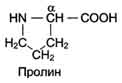
Некоторые функц. гр-пы в радикалах а-т появляются после синтеза белка.

3. А-ты различаются по их растворимости в воде. Это связано со СП-тьюрадикалов вз-ть с водой(гидрироваться). К гидрофильным относятся радикалы, содержащие анионные, катионные и полярные незаряженные функц. гр-пы. К гидрофобным относятся радикалы,содержащие метильные гр-пы , алифатические цепи или циклы.
4. Пептидные связи соединяют а-ты в пептиды. Альфа –корбоксильная группа 1й а-ты может реагировать с альфа-иминогруппой другой а-ты с обр-м пептидной связи.

Пептидные цепи белков представляют собой полипептиды,те линейные полимеры альфа а-т,соединен пептид связью.

Первичная структура белка несет информ. о его пространственной структуре. Первичная структура белка - это последовательность ковалентно связанных пептидными связями аминокислот, составляющих белок.Пептидная связь образуется за счет -карбоксильной группы одной аминокислоты и -аминной группы другой что -аминогруппа находится слева, а -карбоксильная группа — справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки — соответственно N-концевым и С-концевым остатками.
3.Конформация пептидных цепей в белках(вторичная и третичная структура)вторичная-пространственная структура, обр-ся в результате вз-вияй между функц. группами пептидного остова. альфа-спираль и бета-спираль. В Альфа-спирали водородные св-зи обр-ся между атомом кислорода карбокс. гр-пы и водородом амидного азота через 4 а-ты; боковые цепи а-х остатков нах на периферии спирали Ветта-структура обр между линейными областями одной полипептид. цепи,обр-я складки. Полипептидные цепи или их части могут обр-ть параллельные и антипараллельные бета структуры.
третичная-трехмерная пространственная структура,обр-ся за счет вз-й между радикалами а-т,СПС располагаться на значительном расстоянии друг от друга в пептидной цепи.
Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих -спирали и -складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру, следует отметить:
а) дисульфидный мостик (–S–S–) между двумя остатками цистеина;
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой);
в) солевой мостик (между карбоксильной группой и аминогруппой);
г) водородные связи между группами -СО - и -NH-;
Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность.
конформационная лабильность-спс. белков к небольшим изменениям конформации за счет разрыва одних и обр-я других слабых связей.
5.Лабильность пространственной структуры белков и их денатурация.Факторы,вызывающие денатурацию.
Денатурация-разрушение их нативной конформации,вызван разрывом связей ,стабилизирующих пространств. структуры,при действии денатурирующих агентов.
никальная трехмерная структура каждого белка разрушается , и все молекулы одного белка приобретают случайную конформацию
радикалы а-т ,форм активный центр, оказываются пространственно удаленными друг от друга,те разруш спецеф. центр связывания белка с лигандом
гидрофобные радикалы оказываются на пов-ти молекулы=создаются условия для агрегации белков(агрегаты белков выпадают в осадок)
разрушаются 2е 3е 4е структуры
факторы:высокая температура-разруш слабых связей в белке; кислоты и щелочи-изменение ионизации иогенных групп,разрыв ионных и водородных связей; мочевина-разруш внутримолек. водородных связей и из-за обр-я водород связей+мочевина; спирт, фенол, хлорамин-разруш гидрофобных и водород связей ; соли тяжелых металлов-обр-е нераствор солей белков и ионов тяжелых металлов
