
- •3.6. Применение альдегидов и кетонов
- •Реакции ацилирования
- •Ацилирование посредством кислоты
- •17. Уксусноэтиловый эфир
- •18. Бензойноэтиловый эфир
- •19. Диэтиловый эфир щавелевой кислоты
- •Ацилирование посредством ангидрида кислоты
- •20. Ацетанилид
- •Ацилирование посредством хлорангидрида кислоты
- •21. Глицеринтрибензоат
- •65. Реакции гидролиза ангидридов, сложных эфиров, амидов.
- •66. Применение и биомедицинское значение карбоновых кислот и их производные.
- •68. Стереоизомерия моносахаридов. Эпимеры. Цикло-оксо-таутомерия на примере глюкозы и фруктозы. Альфа и бета аномеры.
- •69. Образование о-гликозидов. Гликолиз гликозидов.
- •Вопрос 96.
- •Вопрос 95.
- •Вопрос 94.
- •Вопрос 93.
- •Вопрос 92.(ребят очень мало нашла)
- •Вопрос 91.
- •Вопрос 90.
65. Реакции гидролиза ангидридов, сложных эфиров, амидов.
Гидролиз ангидридов:
![]()
Гидролиз сложных эфиров:
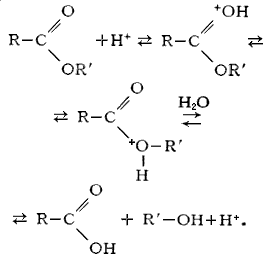
66. Применение и биомедицинское значение карбоновых кислот и их производные.
К. к., их производные, а также многочисленные соединения, содержащие наряду с карбоксильной иные функциональные группы (например, Аминокислоты, Оксикислоты и др.), имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид — в производстве ацетилцеллюлозы (См. Ацетилцеллюлоза). Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n-аминосалициловую кислоту (ПАСК) и др.
Высшие жирные К. к. широко применяют как сырьё для производства Мыла, лаков (См. Лаки) и красок (См. Краски), поверхностно-активных веществ, как эмульгаторы в производстве каучуков, как пластификаторы в производстве резин и др. Адипиновая кислота — один из исходных продуктов в производстве полиамидного волокна (См. Полиамидные волокна) (найлона), терефталевая — в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло.
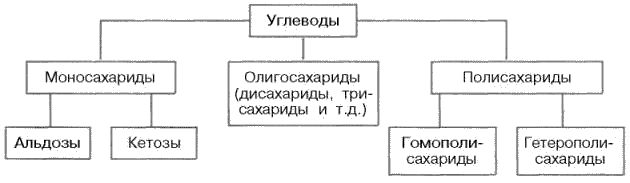
67. Классификация углеводов. Строение моносахаридов: глюкозы, маннозы, галактозы, фруктозы, рибозы, дезоксирибозы.Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
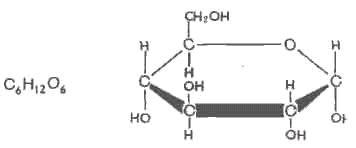
Глюкоза:
Манноза:
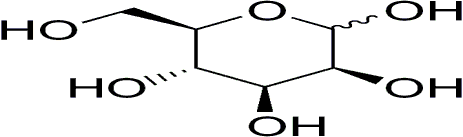
Галактоза:
![]()
Фруктоза:
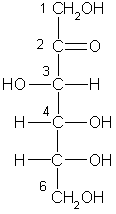
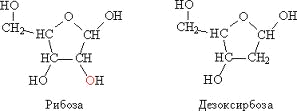
Рибоза и дезоксирибоза:
68. Стереоизомерия моносахаридов. Эпимеры. Цикло-оксо-таутомерия на примере глюкозы и фруктозы. Альфа и бета аномеры.
Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров.
Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров.
Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:
Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров (24), представителем которых является, например, глюкоза. Для альдопентоз и альдотетроз число сте-реоизомеров равно соответственно 23 = 8 и 22 = 4.
Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда (схема 5.1).
Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного луча света – одна из важнейших особенностей веществ (в том числе моносахаридов), молекулы которых имеют асимметричный атом углерода или асимметричны в целом. Свойство вращать плоскость поляризованного луча вправо обозначают знаком плюс (+), а в противоположную сторону – знаком минус (–). Так, D-глицеральдегид вращает плоскость поляризованного луча вправо, т. е. D-глицеральдегид является D(+)-альдотриозой, а L-гли-церальдегид – L(–)-альдотриозой. Однако направление угла вращения поляризованного луча, которое определяется асимметрией молекулы в целом, заранее непредсказуемо. Моносахариды, относящиеся по стереохимической конфигурации к D-ряду, могут быть левовращающими. Так, обычная форма глюкозы, встречающаяся в природе, является правовращающей, а обычная форма фруктозы – левовращающей.
Эпимеры:Диастереомеры моносахаридов, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры — частный случай диастереомеров. Например, D-глюкоза и D-галактоза отличаются друг от друга только конфигурацией С-4, т. е. являются эпимерами по С-4. Аналогично D-глюкоза и D-манноза — эпимеры по С-2.
