
- •3.6. Применение альдегидов и кетонов
- •Реакции ацилирования
- •Ацилирование посредством кислоты
- •17. Уксусноэтиловый эфир
- •18. Бензойноэтиловый эфир
- •19. Диэтиловый эфир щавелевой кислоты
- •Ацилирование посредством ангидрида кислоты
- •20. Ацетанилид
- •Ацилирование посредством хлорангидрида кислоты
- •21. Глицеринтрибензоат
- •65. Реакции гидролиза ангидридов, сложных эфиров, амидов.
- •66. Применение и биомедицинское значение карбоновых кислот и их производные.
- •68. Стереоизомерия моносахаридов. Эпимеры. Цикло-оксо-таутомерия на примере глюкозы и фруктозы. Альфа и бета аномеры.
- •69. Образование о-гликозидов. Гликолиз гликозидов.
- •Вопрос 96.
- •Вопрос 95.
- •Вопрос 94.
- •Вопрос 93.
- •Вопрос 92.(ребят очень мало нашла)
- •Вопрос 91.
- •Вопрос 90.
Ацилирование посредством ангидрида кислоты
20. Ацетанилид
Ацетилирование (т. е. замещение водорода на остаток уксусной кислоты - ацетил) анилина производят или нагревая его с избытком ледяной уксусной кислоты, или (что более удобно) путем взаимодействия анилина с уксусным ангидридом:
Реактивы: Анилин.....................18,6 г (0,2 моля) Соляная кислота конц.......17 мл (0,2 моля) Уксусный ангидрид..........25 мл (около 0,25 моля) Активный уголь; уксуснокислый натрий крист.
В литровом стакане к 500 мл воды приливают 17 мл концентрированной соляной кислоты и при помешивании прибавляют анилин. Если раствор получается окрашенным, то прибавляют 3-4 г активного угля, перемешивают в течение 5 мин. и фильтруют. Бесцветный раствор нагревают до 50°, приливают уксусный ангидрид и перемешивают до полного его растворения. Затем немедленно приливают раствор 30 г уксуснокислого натрия в 100 мл воды, хорошо перемешивают и охлаждают льдом. Выпавшие кристаллы ацетанилида отфильтровывают на воронке Бюхнера, отсасывают и промывают небольшим количеством ледяной воды. Продукт получается достаточно чистым; в случае необходимости его можно перекристаллизовать из воды.
Выход 21-22 г.
Темп. пл. 115°.
Препарат может быть использован для получения п-нитроанилина.
Ацилирование посредством хлорангидрида кислоты
Примеры ацилирования посредством хлорангидрида кислоты в присутствии щелочи были приведены ранее (см. 10. Хлористый бензоил и 11. Хлористый п-нитробензоил).
В некоторых случаях бензоилирование протекает более гладко, если водный раствор щелочи заменить пиридином, который является хорошим растворителем для большинства органических соединений. В качестве промежуточного продукта при этом образуется бензоилпиридинийхлорид, отличающийся большой реакционной способностью:
Бензоилпиридинийхлорид при взаимодействии со спиртами образует солянокислый пиридин и соответствующий бензойный эфир:
В присутствии воды бензоилпиридинийхлорид образует бензойный ангидрид, который может загрязнять основной продукт реакции:
21. Глицеринтрибензоат
Примером бензоилирования в присутствии пиридина может служить получение глицеринтрибензоата:
Реактивы: Глицерин..............1,8 г (0,02 моля) Хлористый бензоил.....7 мл или 8,4 г (0,06 моля) Пиридин; серная кислота; спирт
В конической колбе смешивают глицерин с 9 мл чистого пиридина и к охлаждаемому льдом раствору понемногу прибавляют хлористый бензоил.
Из раствора, принимающего красную окраску, выпадает обильный осадок солянокислого пиридина. Смесь оставляют стоять несколько часов и затем прибавляют холодную разбавленную (10%) серную кислоту. Солянокислый пиридин при этом растворяется, а трибензоат глицерина выпадает в виде осадка, который отсасывают, хорошо промывая водой, высушивают и перекристаллизовывают из спирта.
Выход около 6 г.
Темп. пл. 76°.

*1Равновесный характер и кинетика реакции этерификации изучены Н. А. Меншуткиным. Установлено, что с наибольшей скоростью протекает реакция этерификации первичных спиртов, с наименьшей - третичных. Аналогичные соотношения скоростей реакции этерификации наблюдаются у кислот, содержащих карбоксильную группу при различных атомах углерода (первичном, вторичном или третичном).
Билет 64.
Механизм нуклеофильного замещения карбоновых кислот на примере реакции этерификации.
Образование сложных эфиров при взаимодействии карбоновых кислот со спиртами (этерификация) происходит в условиях кислотного катализа как реакция нуклеофильного замещения. При этом в молекуле карбоновой кислоты RCOOH замещается гидроксильная группа -ОН на группу -OR' от молекулы спирта R'OH (в приведенном ниже примере R' = C2H5).
То, что гидроксил отщепляется именно от молекулы кислоты доказано с помощью метода меченых атомов. Если молекула исходного спирта содержит изотоп кислорода 18O, то этот "меченый атом" оказывается в молекуле сложного эфира.
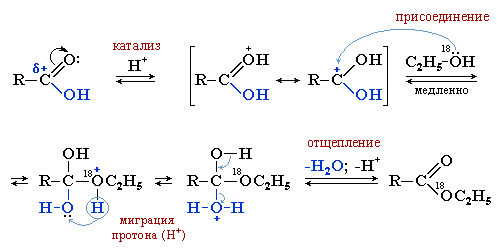
Реакция включает несколько обратимых стадий.
Стадия I. Активация карбоновой кислоты под действием катализатора – сильной кислоты (например, конц. H2SO4), превращающей нейтральную молекулу в карбокатион.
Стадия II (лимитирующая). Нуклеофильное присоединение спирта к карбокатиону.
Стадия III. Миграция протона H+ и формирование хорошей уходящей группы H2O.
Стадия IV. Отщепление воды и катализатора (H+) от неустойчивого продукта присоединения с образованием cложного эфира.
Данный процесс классифицируют как реакцию присоединения-отщепления, т.к. сначала образуются продукты нуклеофильного присоединения (стадия II), которые затем вследствие неустойчивости отщепляют "хорошую уходящую группу" (воду).
