
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5 atom бора – зоммерфельда
- •Вопрос 5
- •Вопрос 6
- •Решение уравнения Шредингера для атома водорода (и водоро-доподобных атомов).
- •5.1. Уравнение Шредингера для атома водорода.
- •7. Электронная конфигурация атома. Правила заполнения электронных оболочек атомов.
- •11. Радиусы атомов и ионов. Орбитальные и эффективные радиусы. Изменение атомных и ионных радиусов в периодах и группах п.С. Эффекты d- и f-сжатия.
- •12. Энергия сродства к электрону. Факторы, определяющие величину сродства к электрону. Изменение величин сродства по периодам и группам Период.Сис.
- •13. Ионизационный потенциал и энергия ионизации. Факторы, определяющие величину ионизационного потенциала. Изменения величин ионизационного потенциала по периодам и группам на примере 5 группы.
- •№19. Донорно-акцепторная связь.
- •№22 Метод молекулярных орбиталей.
- •№23. Ионная связь.
- •№24. Теория поляризации.
- •28. Влияние температуры на скорость химических реакций. Энергия активации. Факторы, влияющие на энергию активации.
- •31.Химическое равновесие. Константа хим. Равновесия. Сдвиг химического равновесия
- •32. Растворы, образование растворов. Электролитическая диссоциация. Механизм диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
- •33. Растворимость веществ. Влияние различных факторов на растворимость. Растворение как физико-химический процесс.
- •1).Давление
- •2).Температура
- •34. Силтные и слабые электролиты. Активность ионов. Равновесие в растворах слабых эликтролитов. Связь константы и степени диссоциации.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель. Определить pH 0,1 м раствора гидроксида калия и 0,01 м раствора серной кислоты.
- •36.Гидролиз солей. Типы гидролиза солей. Константа гидролиза. Влияние различных факторов на гидролиз.
- •Аммиак (nh3), гидразин (n2h4), гидроксиламин (nh2oh)
- •55. Общая характеристика VI а группы периодической системы. Сера, селен и теллур, свойства простых веществ. Изменение свойств в рядах гидроксосоединений в степенях окисления (IV) и (VI).
- •Пероксид водорода
- •Производство серной кислоты
- •Химические свойства
- •59. Общая характеристика подгруппы галогенов. Нахождение в природе, получение. Изменение физических и химических свойств в ряду простых веществ галогенов общая характеристика
- •Медь и её соединения
- •Химические свойства
- •Серебро и его соединения
- •Золото и его соединения
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •1. Общая характеристика подгруппы хрома
- •Соединения хрома Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •Краткая характеристика триады железа
- •2.2) Физические свойства кобальта
- •2.3) Физические свойства никеля
- •3) Химические свойства элементов
11. Радиусы атомов и ионов. Орбитальные и эффективные радиусы. Изменение атомных и ионных радиусов в периодах и группах п.С. Эффекты d- и f-сжатия.
Ио́нный ра́диус — характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие ионный радиус основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке. Ионный радиус зависит от многих факторов, таких как заряд и размер ядра, количество электронов в электронной оболочке, её плотность, обусловленная кулоновским взаимодействием.
Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается. Происходит своеобразное их сжатие. В начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и большим радиусом атома. Электроны, находящиеся дальше от ядра, легко от него отрываются, что характерно для элементов-металлов. В одной и той же группе с увеличением номера периода атомные радиусы возрастают, т.к. увеличение заряда атома оказывает противоположный эффект.
Атомный радиус - характеристика атомов, позволяющая приблизительно оценивать межатомные расстояния в веществах. Ионный радиус - величина, характеризующая размер катионов и анионов.
Радиус атома - границы электронного облака. Вследствие принципа неопределенности не может быть точно определен. Если за радиус свободного атома принимается положение главного максимума плотности внешних электронных облаков, это называется орбитальным радиусом.
Изменение атомных радиусов в периодической системе носит периодический характер, так как определяется свойствами электронных оболочек. В периодах атомные радиусы в общем уменьшаются, в подгруппах - увеличиваются.
Радиусы атомов, связанных между собой, называют эффективными. Эффективные радиусы определяют при изучении строения молекул и кристаллов.
Во многих случаях кратчайшее расстояние между двумя атомами действительно примерно равно сумме соответствующих атомных радиусов. В зависимости от типа связи между атомами различают металлические, ионные, ковалентные и некоторые другие атомные радиусы.
При движении по периодам и группам таблицы Д.И. Менделеева (сверху вниз) заряд ядра и суммарный заряд электронов увеличиваются, и силы притяжения между ними возрастают. Однако следует иметь ввиду, что, если заряд ядра можно условно рассматривать как точечный, то электроны распределяются по энергетическим уровням. С увеличением числа уровней (слоев) электроны удаляются от ядра, и силы притяжения между ядром и электронами ослабляются. Далее надо учесть, что каждый уровень "расщепляется" на подуровни. Среди подуровней появляются d- и f-подуровни, наиболее плотно заполненные электронами. Начинает действовать эффект d- и f-сжатия, конкурирующий с удалением электронов от ядра.
12. Энергия сродства к электрону. Факторы, определяющие величину сродства к электрону. Изменение величин сродства по периодам и группам Период.Сис.
Сродство атома к электрону Ae - способность атомов присоединять добавочный электрон и превращаться в отрицательный ион. Мерой сродства к электрону служит энергия, выделяющая или поглощающаяся при этом. Сродство к электрону равно энергии ионизации отрицательного иона Х−:
Х− = Х + е−
Наибольшим сродством к электрону обладают атомы галогенов. Например, для атома фтора присоединение электрона сопровождается выделением 327,9 кДж/моль энергии.
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)
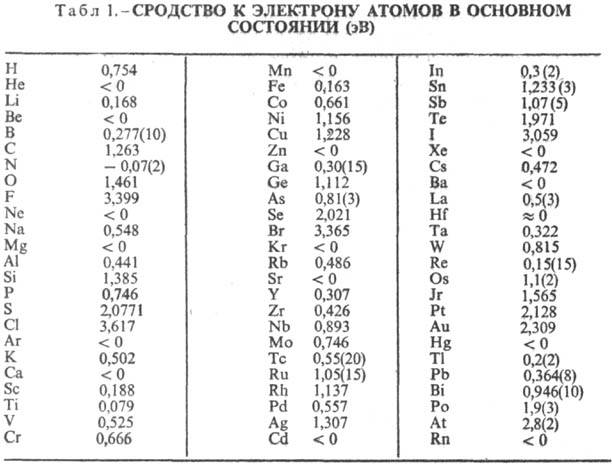
Наибольшим сродством к электрону обладают атомы галогенов. Для ряда элементов сродство к электрону близко к нулю или меньше нуля. Последнее означает, что для данного элемента устойчивого отрицат. иона не существует. В табл. 1 приведены значения сродства к электрону атомов, полученные методом фотоэлектронной спектроскопии (работы У. Лайнебергера с сотрудниками).
Сродство к электрону молекул составляет, как правило, От 0 до 4 эВ (табл. 2).
Обнаружены молекулы с очень высокими значениями сродства к электрону-гекса-, пента- и тетрафториды переходных металлов. Наибольшим из известных в настоящее время значений сродства к электрону обладает PtF6 (7,00 b 0,35 эВ).

Сродство к электрону определяет окислит. способность частицы. Молекулы с высокими значениями сродства к электрону-сильныеокислители. С их помощью были получены хим. соед. благородных газов, соед. внедрения в графите.
Существование многозарядных (Двух- и более) многоатомных отрицат. ионов в основном состоянии в газовой фазе до сих пор экспериментально не подтверждено. Возможен лишь квантовомех. расчет или расчет по циклу Борна-Габера второго или более высокого сродства к электрону для молекул. Для ряда молекул второе сродство к электрону, полученное таким способом, является существенно положительным (PtF6 3,8 эВ, CrF6 2,44 эВ).
