
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5 atom бора – зоммерфельда
- •Вопрос 5
- •Вопрос 6
- •Решение уравнения Шредингера для атома водорода (и водоро-доподобных атомов).
- •5.1. Уравнение Шредингера для атома водорода.
- •7. Электронная конфигурация атома. Правила заполнения электронных оболочек атомов.
- •11. Радиусы атомов и ионов. Орбитальные и эффективные радиусы. Изменение атомных и ионных радиусов в периодах и группах п.С. Эффекты d- и f-сжатия.
- •12. Энергия сродства к электрону. Факторы, определяющие величину сродства к электрону. Изменение величин сродства по периодам и группам Период.Сис.
- •13. Ионизационный потенциал и энергия ионизации. Факторы, определяющие величину ионизационного потенциала. Изменения величин ионизационного потенциала по периодам и группам на примере 5 группы.
- •№19. Донорно-акцепторная связь.
- •№22 Метод молекулярных орбиталей.
- •№23. Ионная связь.
- •№24. Теория поляризации.
- •28. Влияние температуры на скорость химических реакций. Энергия активации. Факторы, влияющие на энергию активации.
- •31.Химическое равновесие. Константа хим. Равновесия. Сдвиг химического равновесия
- •32. Растворы, образование растворов. Электролитическая диссоциация. Механизм диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
- •33. Растворимость веществ. Влияние различных факторов на растворимость. Растворение как физико-химический процесс.
- •1).Давление
- •2).Температура
- •34. Силтные и слабые электролиты. Активность ионов. Равновесие в растворах слабых эликтролитов. Связь константы и степени диссоциации.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель. Определить pH 0,1 м раствора гидроксида калия и 0,01 м раствора серной кислоты.
- •36.Гидролиз солей. Типы гидролиза солей. Константа гидролиза. Влияние различных факторов на гидролиз.
- •Аммиак (nh3), гидразин (n2h4), гидроксиламин (nh2oh)
- •55. Общая характеристика VI а группы периодической системы. Сера, селен и теллур, свойства простых веществ. Изменение свойств в рядах гидроксосоединений в степенях окисления (IV) и (VI).
- •Пероксид водорода
- •Производство серной кислоты
- •Химические свойства
- •59. Общая характеристика подгруппы галогенов. Нахождение в природе, получение. Изменение физических и химических свойств в ряду простых веществ галогенов общая характеристика
- •Медь и её соединения
- •Химические свойства
- •Серебро и его соединения
- •Золото и его соединения
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •1. Общая характеристика подгруппы хрома
- •Соединения хрома Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •Краткая характеристика триады железа
- •2.2) Физические свойства кобальта
- •2.3) Физические свойства никеля
- •3) Химические свойства элементов
Производство серной кислоты
1-я стадия. Печь для обжига колчедана.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита)
2) метод "кипящего слоя"
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
2-я стадия. После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V2O5):
2SO2 + O2 = 2SO3
3-я стадия. Поглотительная башня:
nSO3 + H2SO4(конц)= (H2SO4 • nSO3)(олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Химические свойства
H2SO4 - сильная двухосновная кислота
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4(разб) = Zn+2SO4 + H2O
b) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2+6SO4 ® Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2+6SO4 ® 4Na2+1SO4 + H2S-2 + 4H2O
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С0 + 2H2S+6O4(конц) ® C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) ® 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) ® 5S+4O2 + 2H3P+5O4 + 2H2O
3) с основными оксидами:
CuO + H2SO4 ® CuSO4 + H2O
CuO + 2H+ ® Cu2+ + H2O
4) с гидроксидами:
H2SO4 + 2NaOH ® Na2SO4 + 2H2O
H+ + OH- ® H2O
H2SO4 + Cu(OH)2 ® CuSO4 + 2H2O
2H+ + Cu(OH)2 ® Cu2+ + 2H2O
5) обменные реакции с солями:
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
Ba2+ + SO42- ® BaSO4¯
H2SO3
![]()
Сернистая кислота
Химические свойства
Кислота средней силы:
![]()
![]()
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
![]()
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
![]()
и средние — сульфиты (в избытке щёлочи):
![]()
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
![]()
При
взаимодействии с ещё более сильными
восстановителями может играть
роль окислителя:
![]()
58. Оксокислоты серы в степени окисления (VI), строение, получение и свойства. Тиосерная кислота, строение и окислительно-восстановительные свойства. Пероксокислоты серы и пероксид водорода, сравнение структуры и свойств.
Многообразие оксокислот серы (VI).
Серную
кислоту H2SO4 правильнее
называть ортосерной кислотой, так как
в ней содержится наибольшее число
гидроксильных групп, связанных с одним
атомом серы (VI). При дегидратации H2SO4или
при насыщении водного раствора серной
кислоты триоксидом серы: H2SO4 +
SO3 =
H2S2O7
два тетраэдра ![]() связываются
общим атомом кислорода в вершине
тетраэдра в дисерную кислоту H2S2O7 (рис.9,
направление I).
связываются
общим атомом кислорода в вершине
тетраэдра в дисерную кислоту H2S2O7 (рис.9,
направление I).

Известны олигомерные ионы (SnO3n+1)2- , где n = 1,2,3,....
Большинство оксокислот серы (VI) генетически удобно рассматривать как результат замещения кислорода или гидроксильной группы на изоэлектронные частицы.
При замещении в H2SO4 концевого атома кислорода на атом серы (направление II на рис.9) и атом селена образуется тиосерная кислота H2S2O3 и селеносерная H2SSeO3 кислота, соответственно. В свою очередь, замещение мостикового атома кислорода в дисерной кислоте на один или цепочку атомов серы (путь III на рис.9) возникает ряд политионовых кислот, а на пероксидную группу - О- О- (путь IV на рис.9) - пероксодисерная кислота. Гидроксильная группа - ОН в H2SO4 может заместиться на гидропероксогруппу - ООН (путь V на рис.9) с образованиемпероксомоносерной кислоты, или кислоты Каро H2SO5, а также на атом галогена или аминогруппу - NH2 (путь VI на рис.9) с образованием галогенсульфоновой (Х = F, Cl) или сульфаминовой(NH2)(HO)SO2 кислот, соответственно.

Рис.9. Схема оксокислот серы (VI).
Тиосерная
кислота и тиосульфаты.
При
кипячении раствора сульфита натрия с
порошком серы образуется тиосульфат
натрия Na2S2O3:
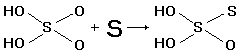 Свободная тиосерная
кислота H2S2O3 в
присутствии воды необратимо распадается
по упрощенной схеме: H2S2O3
Свободная тиосерная
кислота H2S2O3 в
присутствии воды необратимо распадается
по упрощенной схеме: H2S2O3 ![]() H2SO3 +
S
H2O
+ SO2+
S, поэтому выделить ее из водных растворов
невозможно. Свободная кислота получена
при низкотемпературном взаимодействии
сероводорода и хлорсульфоновой кислоты:
HSO3Cl
+ H2S
H2S2O3 +
HCl. Ниже 0оС
H2S2O3 количественно
распадается: 3H2S2O3
3H2O
+ 2SO3 +
S (интересно сопоставить эту реакцию с
распадом серной кислоты H2SO4
H2O+SO3 выше
ее температуры кипения).
В
отличие от кислоты ее устойчивые соли
легко образуются при взаимодействии
растворов сульфитов с H2S:
H2SO3 +
S
H2O
+ SO2+
S, поэтому выделить ее из водных растворов
невозможно. Свободная кислота получена
при низкотемпературном взаимодействии
сероводорода и хлорсульфоновой кислоты:
HSO3Cl
+ H2S
H2S2O3 +
HCl. Ниже 0оС
H2S2O3 количественно
распадается: 3H2S2O3
3H2O
+ 2SO3 +
S (интересно сопоставить эту реакцию с
распадом серной кислоты H2SO4
H2O+SO3 выше
ее температуры кипения).
В
отличие от кислоты ее устойчивые соли
легко образуются при взаимодействии
растворов сульфитов с H2S: ![]() или
при кипячении их растворов с серой* ):
или
при кипячении их растворов с серой* ): ![]() ,
а также при окислении полисульфидов
кислородом воздуха: CaS2+
3/2 O2
CaS2O3 или
Na2S5 +
3/2 O2
Na2S2O3 +3S.
По
строению ион тиосульфата близок к
иону
,
а также при окислении полисульфидов
кислородом воздуха: CaS2+
3/2 O2
CaS2O3 или
Na2S5 +
3/2 O2
Na2S2O3 +3S.
По
строению ион тиосульфата близок к
иону ![]() :
тетраэдр [SO3S]
несколько искажен из-за большей длины
связи S-S (1.97
:
тетраэдр [SO3S]
несколько искажен из-за большей длины
связи S-S (1.97![]() )
по сравнению со связью S- O (1.48
).
В
связи с наличием атомов серы в степени
окисления - 2 ион
)
по сравнению со связью S- O (1.48
).
В
связи с наличием атомов серы в степени
окисления - 2 ион ![]() обладает
восстановительными свойствами, например,
слабыми окислителями (I2,
Fe3+)
тиосульфат окисляется до иона тетратионата:
2S2O32- +
I2
S4 O6 2- +
2I- ,
а более сильными окислителями - до иона
сульфата:
обладает
восстановительными свойствами, например,
слабыми окислителями (I2,
Fe3+)
тиосульфат окисляется до иона тетратионата:
2S2O32- +
I2
S4 O6 2- +
2I- ,
а более сильными окислителями - до иона
сульфата:![]() (в
связи с использованием в последней
реакции ранее тиосульфат называли
"антихлором").
Сильными
восстановителями ион
восстанавливается
до производных S(2-):
(в
связи с использованием в последней
реакции ранее тиосульфат называли
"антихлором").
Сильными
восстановителями ион
восстанавливается
до производных S(2-):
![]() Тиосульфат-ион
- сильный комплексообразователь,
использующийся в фотографии для удаления
из фотопленки невосстановленного
бромида серебра:
Тиосульфат-ион
- сильный комплексообразователь,
использующийся в фотографии для удаления
из фотопленки невосстановленного
бромида серебра:
![]() .
Отметим,
что металлами S2O32- ион
координируется через атом серы, поэтому
тиосульфатные комплексы легко превращаются
в соответствующие сульфиды, например,
.
Отметим,
что металлами S2O32- ион
координируется через атом серы, поэтому
тиосульфатные комплексы легко превращаются
в соответствующие сульфиды, например,
![]() .
.
К пероксокислотам серы относятся H2S05 и H2S2O8
:
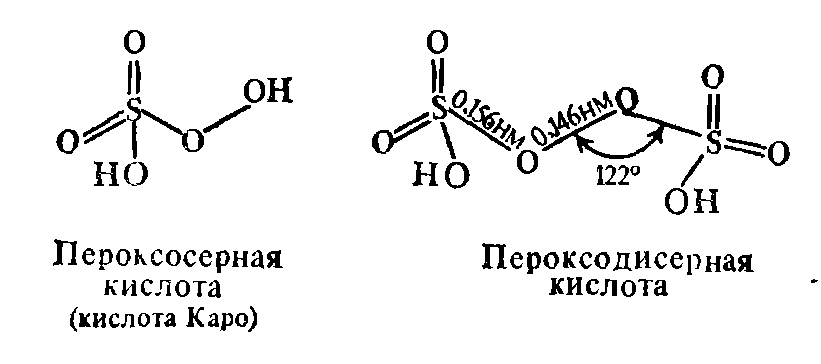
Обе кислоты являются производными пероксида водорода. Пероксодисерная кислота получается, если концентрированный раствор гидросульфата калия или H2S04 подвергнуть электролизу.
K2S208 — пероксосульфат калия, малорастворим в воде и легко из раствора осаждается.
При взаимодействии H2S2Oe с концентрированным Н202 может быть получена пероксосерная кислота: H2S2O8 + H202 = 2H2S06
Кислота H2S2O8 — бесцветные кристаллы, плавящиеся с разложением при 65 °С. Она обладает сильными окислительными свойствами: обугливает бумагу, сахар и даже парафин. Кислота H2SO5—твердое гигроскопичное вещество, является более сильным окислителем, чем H2S2O8; например, взаимодействие H2S05 с бензолом протекает со взрывом. Соли H2S05 малоустойчивы. Соли H2S208 называются пероксосульфатами (персульфатами), они обладают сильными окислительными свойствами. Под действием пероксосульфатов из растворов солей марганца (II), свинца (II), никеля (II) и кобальта (II) осаждаются высшие оксиды этих металлов, соли хрома (III) переходят в хроматы. В сухом состоянии пероксосульфаты совершенно устойчивы, все они хорошо растворимы в воде.
