
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5 atom бора – зоммерфельда
- •Вопрос 5
- •Вопрос 6
- •Решение уравнения Шредингера для атома водорода (и водоро-доподобных атомов).
- •5.1. Уравнение Шредингера для атома водорода.
- •7. Электронная конфигурация атома. Правила заполнения электронных оболочек атомов.
- •11. Радиусы атомов и ионов. Орбитальные и эффективные радиусы. Изменение атомных и ионных радиусов в периодах и группах п.С. Эффекты d- и f-сжатия.
- •12. Энергия сродства к электрону. Факторы, определяющие величину сродства к электрону. Изменение величин сродства по периодам и группам Период.Сис.
- •13. Ионизационный потенциал и энергия ионизации. Факторы, определяющие величину ионизационного потенциала. Изменения величин ионизационного потенциала по периодам и группам на примере 5 группы.
- •№19. Донорно-акцепторная связь.
- •№22 Метод молекулярных орбиталей.
- •№23. Ионная связь.
- •№24. Теория поляризации.
- •28. Влияние температуры на скорость химических реакций. Энергия активации. Факторы, влияющие на энергию активации.
- •31.Химическое равновесие. Константа хим. Равновесия. Сдвиг химического равновесия
- •32. Растворы, образование растворов. Электролитическая диссоциация. Механизм диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
- •33. Растворимость веществ. Влияние различных факторов на растворимость. Растворение как физико-химический процесс.
- •1).Давление
- •2).Температура
- •34. Силтные и слабые электролиты. Активность ионов. Равновесие в растворах слабых эликтролитов. Связь константы и степени диссоциации.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель. Определить pH 0,1 м раствора гидроксида калия и 0,01 м раствора серной кислоты.
- •36.Гидролиз солей. Типы гидролиза солей. Константа гидролиза. Влияние различных факторов на гидролиз.
- •Аммиак (nh3), гидразин (n2h4), гидроксиламин (nh2oh)
- •55. Общая характеристика VI а группы периодической системы. Сера, селен и теллур, свойства простых веществ. Изменение свойств в рядах гидроксосоединений в степенях окисления (IV) и (VI).
- •Пероксид водорода
- •Производство серной кислоты
- •Химические свойства
- •59. Общая характеристика подгруппы галогенов. Нахождение в природе, получение. Изменение физических и химических свойств в ряду простых веществ галогенов общая характеристика
- •Медь и её соединения
- •Химические свойства
- •Серебро и его соединения
- •Золото и его соединения
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •1. Общая характеристика подгруппы хрома
- •Соединения хрома Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •Краткая характеристика триады железа
- •2.2) Физические свойства кобальта
- •2.3) Физические свойства никеля
- •3) Химические свойства элементов
35. Диссоциация воды. Ионное произведение воды. Водородный показатель. Определить pH 0,1 м раствора гидроксида калия и 0,01 м раствора серной кислоты.
Вода является очень слабым амфотерным электролитом:
Свободные ионы водорода H не способны к существованию в водном растворе - они мгновенно гидратируются водой до катионов оксония (H3O+). Однако, для простоты записи часто используют обозначение H+:
H2O = H+ + OH-.
Константа диссоциации воды равна:
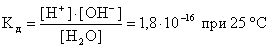
В воде и разбавленных водных растворах электролитов молярная концентрация воды практически постоянна и равна

где 1000 - масса 1 л воды, г; 18 - молярная масса воды, г/моль.
Поэтому можно считать постоянным произведение:
KВ·[H2O] = [H+]·[OH-] = 1,8·10-16·55,6 = 1·10-14 (моль/л)
Произведение равновесных концентраций ионов водорода и гидроксила в воде и разбавленных водных растворах (при постоянной температуре) есть величина постоянная - ионное произведение воды (KВ).
KВ = [H+]·[OH-] = 1·10-14 при 25 С
При увеличении температуры KВ значительно возрастает:
t, С |
0 |
18 |
25 |
30 |
50 |
60 |
KВ·1014 |
0,1139 |
0,5702 |
1,0008 |
1,469 |
5,474 |
9,614 |
Следовательно, в чистой воде при 25 ° С
[H+] = [OH-] = 1·10-7 моль/л.
В водных растворах электролитов молярные концентрации ионов H+ и OH- не обязательно равны 10 моль/л (как в чистой воде), но их произведение при 25 С всегда равно 1·10-14. Следовательно, если задано значение [H+], то легко определить и [OH-], и наоборот:
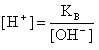
В кислых растворах преобладает концентрация ионов H+:
[H+] > [OH-], т.е. [H+] > 1·10-7 и [OH-] < 1·10-7 моль/л.
В основных растворах преобладает концентрация ионов [OH ]:
[OH-] > [H+], т.е. [OH-] >1·10-7 и [H+] < 1·10-7 моль/л.
Для удобства вместо значений [H+] используют водородный показатель pH. Водордный показатель есть отрицательный десятичный логарифм числового значения молярной концентрации ионов водорода:
pH = -lg[H+]
По аналогии используют гидроксильный показатель (pOH):
pOH = -lg[OH-]
Поскольку KВ = [H+]·[OH-] = const при T = const, то pH + pOH = -lg KВ = f(T).
При 25 С pH + pOH = -lg 1·10-14 = 14, или pH = 14 - pOH.
Величина pH используется как мера кислотности, нейтральности или основности водных растворов:
в кислой среде pH < 7,
в нейтральной среде pH = 7,
в основной среде pH > 7.
Значение pH может быть больше 14 или отрицательным (очень кислая среда).
36.Гидролиз солей. Типы гидролиза солей. Константа гидролиза. Влияние различных факторов на гидролиз.
Гидролиз - процесс взаимного разложения воды и растворённого в ней в-ва, приводящий к образованию более слабого электролита и изменение pH раствора
Гидролиз соли - реакция поляризационного взаимодействия ионов соли с молекулами воды, сопровождающуюся образованием малодиссоциирующщих веществ и изменением рН среды.
Ky+ + HOH KOH(y-1) + H+
Ax- + HOH HA(x-1) + OH-
Гидролиз обусловлен образованием малодиссоциирующих частиц KOH(y-1) и HA(x-1).
Чем больше заряд и меньше радиус ионов соли, тем сильнее их поляризационное взаимодействие с водой, слабее диссоциация образующихся частиц KOH(y-1) и HA(x-1) и тем в большей степени происходит гидролиз.
Поляризующее влияние на молекулы воды невелико у катионов s-элементов (исключение составляют Be2+ и Mg2+ ), у анионов сильных кислот, например, Cl-, Br-, I-, NO3-, SO42-, т.е. соли, образованные анионом сильной кислоты и катионом сильного основания, гидролизу не подвергаются (рН = 7).
Возможны следующие случаи гидролиза солей: гидролиз по аниону, по катиону, по катиону и аниону одновременно.
Гидролиз по катиону. Ему подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты (ZnSO4, FeCl2, Co(NO3)2 и др.). При гидролизе создается кислая среда (рН < 7). Характер продуктов гидролиза зависит от природы катиона.
Например:
катион однозарядный.
NH4Cl NH4+ + Cl-
NH4+ + HOH NH3· H2O + H+
молекулярное уравнение гидролиза:
NH4Cl + H2O NH3· H2O + HCl.
Продуктами гидролиза в данном случае являются слабое основание и сильная кислота. Процесс обратим, равновесие гидролиза сильно смещено влево (K(H2O) << K(NH3· H2O)).
катион многозарядный. Гидролиз многозарядного катиона протекает ступенчато, в связи со ступенчатой диссоциацией многокислотных оснований. Например:
CuCl2 Cu2+ + Cl-
Cu2+ + HOH CuOH+ + H+ (1 ступень)
CuOH+ + HOH Cu(OH)2 + H+ (2 ступень)
Молекулярные уравнения, соответственно, имеют вид:
CuCl2 + H2O CuOHCl + HCl (1 ступень)
CuOHCl + H2O Cu(OH)2 + HCl (2 ступень)
Вследствие накопления в смеси ионов H гидролиз (при обычных условиях) протекает, главным образом, по первой ступени. Следовательно, продуктами гидролиза будут основная соль и сильная кислота.
Гидролиз по аниону. Он характерен для солей, образованных катионом сильного основания и анионом слабой кислоты (NaF, K2S, K3PO4, CH3COONa и др.). При гидролизе создается основная среда (рН > 7) Вид продуктов гидролиза зависит от величины заряда и природы аниона. Например:
анион однозарядный.
KCN K+ + CN-
CN- + HOH HCN + OH-
Молекулярное уравнение гидролиза:
KCN + H2O HCN + KOH
Продуктами гидролиза в данном случае являются слабая кислота и сильное основание.
анион многозарядный.
K2CO3 2K+ + CO32-,
CO32- + HOH HCO3-+ OH-
Молекулярное уравнение 1 ступени гидролиза:
K2CO3 + H2O KHCO3 + KOH
В связи с накоплением в реакционной системе ионов OH гидролизом по второй ступени можно пренебречь. Продуктами гидролиза в этом случае будут кислая соль и сильное основание.
Гидролиз по катиону и аниону. Этот случай имеет место для солей, образованных катионом слабого основания и анионом слабой кислоты. Причем, чаще всего независимо от величины заряда катиона и аниона, продуктами гидролиза являются слабое основание и слабая кислота. Характер среды определяется соотношением величины констант диссоциации образующихся кислот и оснований, т.е. их силой. Например:
NH4CN NH4+ + CN-
NH4+ + HOH NH3· H2O + H+
CN- + HOH HCN + OH-
NH4+ + CN- + 2H2O NH3· H2O + HCN + H+ + OH-
Молекулярное уравнение гидролиза:
NH4CN + 2H2O NH3· H2O + HCN
Гидролиз в данном случае протекает довольно интенсивно. Образующиеся при гидролизе ионы H+ и OH- связываются в молекулы H2O, что усиливает гидролиз и по катиону и по аниону. Реакция среды в данном случае слабоосновная (рН несколько больше 7) (K(NH3· H2O) >K(HCN)).
Если кислота и основание, образующие соль, не только являются слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, гидролиз таких солей в ряде случаев протекает практически необратимо. По этой причине сульфиды и карбонаты алюминия, хрома и др. нельзя получить в водном растворе:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl
2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3H2S + 6NaCl
Ионно-молекулярные уравнения гидролиза, соответственно:
2Al3+ + 3CO32- + 3HOH = 2Al(OH)3 + 3CO2
2Cr3+ + 3S2- + 6HOH = 2Cr(OH)3 + 3H2S
Константа гидролиза — константа равновесия гидролитической реакции
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() ,
где
,
где
![]() —
константа диссоциации слабой кислоты,
образующейся при гидролизе
—
константа диссоциации слабой кислоты,
образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
![]() ,
где
,
где
![]() —
константа диссоциации слабого основания,
образующегося при гидролизе
—
константа диссоциации слабого основания,
образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
![]()
Константа гидролиза зависит от природы реагентов и температуры
Равновесие реакции гидролиза можно сместить,используя принцип Ле-Шателье:
1). Разбовление усиливает гидролиз
2). Увеличение температуры усиливает гидролиз
3). Изменение pH раствора: увеличение усиливает гидролиз,а уменьшение подавляет
37) Гидролиз солей. Степень и константа гидролиза. Влияние концентрации растворов, температуры и pH среды на степень гидролиза.
Гидролиз - реакция обменного разложения веществ водой.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Соль, образованная сильным основанием и сильной кислотой, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
Степень гидролиза - отношение числа молекул, подвергающихся гидролизу, к общему числу молекул в растворе.
Степень гидролиза зависит: ( альфа )
1) от природы растворенного вещества
2) от концентрации (чем ниже К, тем выше альфа)
3) от t (чем выше t, тем выше альфа)
4) чем слабее основание, участвующее в образовании соли, тем гидролиз протекает интенсивнее
5) альфа выше при разбавлении водой раствора
Константы гидролиза:
1) Kг = Kw / Kд кисл (слабая кислота, сильное основание)
2) Kг = Kw / Kд осн (сильная кислота, слабое основание)
3) Kг = Kw / Kд кисл × Kд осн ( слабая кислота и слабое основание)
38) Гидролиз кислых солей. Полный гмдролиз. Реакции гидролиза, осложненные процессами полимеризации и деструкции.
Гидролиз - реакция обменного разложения веществ водой.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Полный гидролиз - в результате гидролиза образуется малорастворимое и летучее соединение
 Например:
Al2S3
+ H2O
<=> Al(OH)3
+ H2S
Например:
Al2S3
+ H2O
<=> Al(OH)3
+ H2S

Гидролиз с точки зрения теории поляризации:
1. Чем больше поляризующее действие катиона, тем сильнее гидролиз
2. Чем больше отрицательный заряд аниона и меньше размер, тем увеличивается действие на воду, и происходит гидролиз
3. Чем слабее кислота, тем сильнее ее гидролиз
Особые случаи гидролиза:
1. гидролиз солей, осложненный реакцией полимеризации - ???
2. гидролиз солей, осложненный реакцией деструкции - ???
не могу написать эти реакции. в интернете нет ничего подходящего, а на лекции мы писали только с поликонденсацией и деполимеризацией
39. Труднорастворимые электролиты. Равновесие между осадком и насыщенным раствором. Произведение растворимости. Перевод труднорастворимых осадков в растворимое состояние.
Гетерогенное равновесие в растворах электролитов:
BaSO4 <=> Ba 2+ + SO42-
(тв) (аква) (аква)
Kравн. = [Ba2+][SO42-] = ПР
Произведение растворимости = произведению равновесных молярных концентраций ионов в степени их стехиометрических коэффициентов.
Правило ПР: (ПР величина постоянная при t = 25○C) ПК - произведение концентрации свободных ионов
1) ПК >= ПР выпадает осадок
2) ПК < ПР растворение осадка
3) введение одноименного иона в раствор труднорастворимого электролита уменьшает его растворимость
Для растворения какого-либо практически нерастворимого в воде вещества нужно взять такой реактив, один из ионов которого давал бы малодиссоциирующее соединение с одним из ионов труднорастворимого электролита.
Между насыщенным раствором и осадком устанавливается динамическое равновесие. Вследствие низкой растворимости концентрация труднорастворимого электролита в растворе очень мала, поэтому можно считать, что в растворе он полностью диссоциирован. Иначе говоря, динамическое равновесие в насыщенном растворе устанавливается между твердой фазой вещества и перешедшими в раствор ионами.
40) Обменные реакции между ионами в растворе. Условия протекания реакций обмена. Совместный гидролиз солей.
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов
Например: BaCl2 + NaSO4 <=> BaSO4 (малораствор.) + 2NaCl; K = 1/ПР
Условия протекания реакций ионного обмена в растворах электролитов:
- образование осадка;
- образование газа;
Совместный гидролиз -
- образование слабого электролита.
Совместный гидролиз — это взаимодействие двух солей с водой, при котором не происходит обменной реакции, соли гидролизуются до конца.
1. Ионы двухвалентных металлов при совместном гидролизе образуют основные соли (кроме Hg2+, Be2+ и ионы щелочно-земельных металлов)
2. Ионы трехвалентных (и более) металлов при совместном гидролизе образуют гидроксиды (высокое ПР)
Пример: 2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3 + H2 S + 6NaCl
Kравновесия = K6w(воды) × 1/ПР2(Cr(OH)3) × 1/K3a (H2S)
41) Комплексные соединения. Номенклатура комплексных соединений. Классификация комплексных соединений. Теория строения комплексных соединений Вернера.
Комплексные соединения - 1) молекулярные соединения определенного состава, которые диссоциируют с образованием сложных комплексных ионов, способных к существованию и в растворе и в кристалле;
2) молнкулярные соединения определенного состава, образование которых, из более простых, не связано с образованием новых электронных пар
Основатель учения: Альфред Вернер 1893г.
Координационная теория Вернера
К 90-м годам прошлого столетия был накоплен большой материал по особой группе молекулярных соединений, состав которых нельзя объяснить с позиций классической теории валентности. Соединениями первого порядка или валентно-насыщенными соединениями, называются соединения типа BF3, CH4, NH3, CO2 и др., в которых элемент проявляет свою обычную максимальную валентность. Соединениями высшего порядка, валентно-ненасыщенными, называются соединения, которые получаются при взаимодействии соединений первого порядка друг с другом.
Швейцарский химик ^ Альфред Вернер, один из основателей химии комплексных соединений, Лауреат Нобелевской Премии, в 1893 году предложил теорию соединений высшего порядка, позволившую понять строение и некоторые свойства комплексных соединений. Силы притяжения существуют не только между атомами, но и между молекулами. Комплексными, называются соединения, в узлах кристаллов которых находятся комплексы, способные к самостоятельному существованию в растворе
Атомы могут проявлять не только главную валентность, но и доп. побочную валентность.
Главная валентность - в простых соединениях: CuCl2
Побочная валентность - комплексные соединения высшего порядка:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
Cu - ион комплексообразователь
(NH3)4 - лиганды
Число лигандов во внутренней сфере - координационное число
Координационное число - число связей, которые центральный элемент образовывает с лигандами (молодентатные - 1 связь с комплексообр., бидентатные, полидентатные)
Основу координационной теории Вернера составляют следующие положения:
1) Центральное место в комплексных соединениях занимает комплексообразователь - обычно положительно заряженный ион (чаще всего металл)
2) Вокруг комплексообразователя расположены или координированы лиганды (старое название адденды), т.е. ионы противоположного знака или нейтральные молекулы.
3) Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения.
4) Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексных соединений.
Классификация комплексных соединений:
1) по знаку заряда комплексного иона
[Cu(NH3)4]2+Cu2 катионный
K[Al(OH)4]- анионный
[Pt(NH3)2Cl2] нейтральный
[Ni(NH3)6][Fe(CN)6] бикомплекс
2) по природе лиганда
1. органические
2. неорганические
* аквакомплексы - в которых лигандом выступает вода: [Co(H2O)6]Cl2
* гидраты - [Cu(H2O)4]SO4·H2O
* аммиакаты - комплексы, в которых лигандами служат молекулы аммиака: [Cu(NH3)4]SO4
* ацидокомплексы - комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5]
* гидроксокомплексы -комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4]
3) по внутренней структуре комплексного соединения
поликислоты - многоядерные соединения с кислотными мостиками
H2CrO7
H2[O3-Cr-O-O3] - поликислота
Номенклатура:
По международной номенклатуре
Как писать:
1. Центральный атом
2. Ионные лиганды - в алфавитном порядке
3. Нейтральные лиганды - в алфавитном порядке
Как называть:
Сначала катион, потом анион
1. Лиганды в алфавитном порядке
2. Центральный атом
Анион - к названию -о- (хлоро-, гидроксо-)
Нейтральный - название не меняется, кроме H2O - аква-, NH3 - аммин-, CO - карбонил-)
Например:
[Co3+Cl1-(NH3)5]2+Cl2 пентаамминхлорокобальт (III) или (2+) хлорид
K[Au(OH)4] калий тетрагидрооксоаурат (III) или (1-)
42) Теории связи в комплексных соединниях. Какие свойства комплексных соединений объясняет метод ВС? Объяснить на примере [Co(NH3)6]Cl3 и Na3[Co(NO2)6]
Развитие представлений о природе комплексных соединений тесно связано с созданием и развитием общей теории химической связи. Так в 20-х годах разработаны электростатические представления о химической связи в комплексах. В дальнейшем было разработано 3 квантовомеханических метода. Эти методы не являются противоположными друг другу, наоборот они дополняют друг друга, а зачастую приводят к одинаковым результатам.
1) Коссель, Магнус - электростатическая теория


 Cu2+
+ 4H2O
= [ +- + -+ ]
Cu2+
+ 4H2O
= [ +- + -+ ]
 -
-
-
-
+ +
Катион с высокополяризующим действием - большие легкополяризуемые ионы и молекулы
Взаимодействие между комплексообразователем и ионными или полярными лигандами подчиняется закону Кулона. Ион комплексообразователь притягивает к себе как ионы противоположного знака, так и полярные молекулы. С другой стороны, окружающие комплексообразователь частицы отталкиваются друг от друга, при этом энергия отталкивания тем больше, чем больше частиц группируется вокруг центрального атома.
2) Теория кристаллического поля (Бэге)
Основывается на чисто электростатической модели. Однако в отличие от теории Косселя и Магнуса здесь рассматриваются изменения в электронных оболочках иона комплексообразователя, происходящие под действием лигандов.
Согласно ТКП связь между ядром комплекса и лигандами чисто ионная или ион - дипольная. Ионная в смысле электростатического взаимодействия катиона-комплексообразователя и анионов - лигандов.
1. комплексное соединение устойчиво существует за счет электростатического притяжения центрального атома и лигандов
2. центральный атом рассматривают с учетом его электронного строения и тех изменений, которые вносят лиганды своим электростатическим взаимодействием; при этом сами лиганды рассмативают как заряженые шары
3. взаимодействие между центральным атомом и лигандами количественно рассматривается (описывается электростатическими законами квантового аппарата)
3) Метод валентных схем Полинга.
1. связь между комплексобразователем и лигандами - донорно-акцепторная
комплексообразователь - акцептор
лиганды - доноры
2. орбитали центрального атома, которые участвуют в образовании связи с лигандами подвергаются гибридизации (тип гибридизации определяет геометрию комплекса)
3. допускается дативное π-связывание, что увеличивает устойчивость комплекса
Вот эти штуки стоит проверить, я не уверена в их правильности, просто делала так, как на лекции писали:
[Co(NH3)6]Cl3
[Co(NH3)6]3+
Co 3d74s2
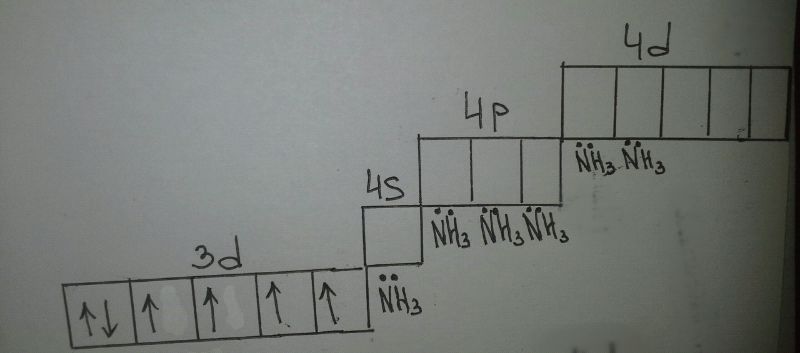
sp3d2 - внешняя гибридизация
парамагнитный комплекс - есть неспареные электроны
Na3[Co(NO2)6]
[Co(NO2)6]3-
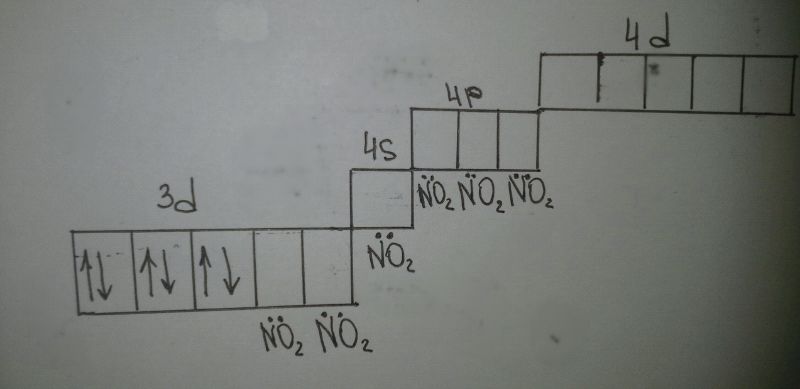
d2sp3 - внутренняя гибридизация
диамагнитый комплекс - все электроны спарены
комплекс более устойчив, менее электроспособен.
49. Общая характеристика IV А группы Периодической системы Д.И.Менделеева. Углерод и кремний. Сравнение свойств простых веществ. Оксиды и диоксиды углерода и кремния, строение молекул и химические свойства. Кремниевые кислоты
Углерод, кремний, германий, олово и свинец составляют главную подгруппу IV группы. Внешние энергетические уровни р-элементов IV группы содержат по четыре электрона (конфигурация ns2np2), из которых два спаренных s-электрона и два неспаренных р-электрона. В невозбужденном состоянии элементы этой подгруппы проявляют валентность, равную двум. При переходе в возбужденное состояние, сопровождающееся переходом одного из s-электронов внешнего уровня в свободную ячейку р-подуровня того же уровня, все электроны наружного слоя становятся неспаренными, и валентность при этом возрастает до 4. нергия, затрачиваемая для перехода электрона, с избытком компенсируется энергией, выделяющейся при образовании четырех связей. В соединениях элементы подгруппы углерода проявляют степень окисления +4 или -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типичная степень окисления +4, для свинца — +2. Степень окисления -4 в последовательности С — Pb становится все менее характерной. Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения формулы — RH4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4: CH4 — прочное вещество, а PbH4 в свободном виде не выделено. При переходе от углерода к свинцу радиусы нейтральных атомов возрастают, а энергия ионизации уменьшается, поэтому от углерода к свинцу убывают неметаллические свойства, а металлические возрастают. Неметаллами являются углерод и кремний
Углерод не принадлежит к числу очень распространенных элементов. Несмотря на это, значение его огромно. Углерод-основа жизни на земле. Он входит в состав весьма распространенных в природе карбонатов (Са, Zn, Mg, Fe и др.), в атмосфере существует в виде СО2, встречается в виде природных углей (аморфного графита), нефти и природного газа, а также простых веществ (алмаза, графита).
Кремний по распространенности в земной коре занимает второе место (после кислорода). Если углерод - основа жизни, то кремний-основа земной коры. Он встречается в громадном многообразии силикатов (рис 4) и алюмосиликатов, песка.
Аморфный кремний - порошок бурого цвета. Последний легко получить в кристаллическом состоянии в виде серых твердых, но довольно хрупких крис таллов. Кристаллический кремний - полупроводник.
Химические свойства углерода и кремния. Графит и кремний — типичные восстановители . При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен) и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
при недостатке кислорода можно получить монооксиды CO или SiO:
2С + О2 = 2СО,
2Si + O2 = 2SiO,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Si + SiO2 = 2SiO.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором, давая СCl4 и SiCl4. При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO.
Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
Кремниевые кислоты-слабые к-ты; для H2SiO3 К1 =(2-3).10-10, К2=10-11-10-13; для H4SiO4 К1=2-10-10, К2=К3=K4=2.10-12. Р-ры кремниевых кислот могут быть получены: р-рением аморфного SiO2 в воде; из р-ров силикатов щелочных металлов взаимод. с к-тами, ионным обменом или электродиализом; гидролизом соед. кремния (напр., хлорсиланов); поликонденсацией одних кремниевых кислот до других и т.д. В равновесном р-ре аморфного SiO2 находятся мономерные формы кремниевых кислот, в осн. H4SiO4. Ортокремниевая к-та стабильна при комнатной т-ре, если концентрация SiO2 в р-ре составляет менее ~0,01% по массе (т.е. не превышает р-римость твердой фазы аморфного кремнезема). Переход H4SiO4 в р-р можно представить схемой:
(SiO2)x+2Н2ОDH4SiO4+(SiO2)x-1
В процессе образования кремниевых кислот вначале получают неустойчивый истинный р-р H4SiO4; эта к-та в дальнейшем, благодаря наличию реакционноспособных силанольных групп SiOH, вступает в поликонденсацию, первая стадия к-рой 2H4SiO4:(HO)3SiOSi(OH)3+Н2О. В результате поликонденсации могут образовываться разнообразные поликремниевые к-ты с линейной, разветвленной, смешанной структурой. К продуктам поликонденсации кремниевыхкислот относятся гидрозоль (коллоидный кремнезем) и гидрогели кремнезема, силикагели (силикаксерогели) и др. Поликремниевые к-ты имеют изоэлектрич. точку в интервале рН 2,0-3,0. Скорость поликонденсации минимальна при рН ~ 2-3, причем в области рН<2 р-ция ускоряется протонами, а при рН>2 - ионами ОН-. Поликонденсация в кислой среде протекает по донорно-акцепторному механизму с образованием переходного комплекса, в к-ром атом Si временно приобретает координац. число 6 (вместо 4). Устойчивость золя кремниевой кислоты зависит от концентрации кремниевой кислоты, т-ры, рН и др. Со временем золь теряет устойчивость и переходит в гель (при рН>7,5 гидрозоль термодинамически устойчив к коагуляции). Скорость гелеобразования максимальна при рН 5,5-6,0. Подбирая соответствующие условия и применяя спец. добавки (стабилизаторы), удается получить устойчивые высококонцeнтрир. золи. Гидрозоли кремнезема-связующие материалы и наполнители в керамич. изделиях, покрытиях, в формах для литья; универсальные носители катализаторов и светочувствит. слоев в фотоматериалах; сырье для получения адсорбентов, кварцевого стекла; поглотители паров и газов в пром. аппаратах; фильтры для очистки воды и минер, масел.
50. Общая характеристика элементов IV А группы периодической системы. Элементы подгруппы германия. Сравнение кислотно-основных свойств гидроксидов в степени окисления (II) и (IV). α- и β-оловянные кислоты. Окислительно-восстановительные свойства соединений в степенях окисления (II) и (IV).
Содержание элементов этой подгруппы в земной коре по ряду германий (2·10–4 %) – олово (6·10–4 %) – свинец (1·10–4 %) изменяется лишь незначительно. Германий принадлежит к весьма рассеянным элементам. Основной формой природного нахождения олова является минерал касситерит (SnO2 ), а свинца – галенит (PbS).
Германий обычно получают как побочный продукт при переработке некоторых цинковых руд. Выплавка олова ведется путем восстановления касситерита углем. Обычным способом переработки галенита является перевод его путем накаливания на. воздухе в РbО, после чего полученная окись свинца восстанавливается до металла углем:
2PbS + ЗО2 = 2SO2 + 2PbO
РbО + С = СО + Рb
Твердость и хрупкость рассматриваемых элементов быстро уменьшаются по ряду Ge–Sn–Pb: в то время как германий довольно тверд и очень хрупок, свинец царапается ногтем и прокатывается в тонкие листы. Олово занимает промежуточное положение. Все элементы подгруппы германия дают сплавы между собой и со многими другими металлами. В некоторых случаях при сплавлении образуются химические соединения (например, типа Mg2 Э).
1) Металлический германий находит важное, но ограниченное по объему применение в радиотехнике. Олово используется главным образом для лужения железа с целью предохранения его от ржавления («белая жесть» консерзной промышленности). Свинец применяется для изготовления аккумуляторных пластин, обкладок электрических кабелей, пуль и дроби, для защиты от рентгеновского излучения и гамма–лучей, а также как коррозионностойкий материалв химической промышленности (трубопроводы и т. д.). Очень большие количества олова и свинца расходуются на изготовление ряда технически важных сплавов. Ежегодная мировая добыча олова составляет около 200 тыс. т, асвинца – около 2 млн. т.
2) Кроме обычного олова (плотность 7,3), известны еще две аллотропические кодификации этого элемента. Ниже +13°С устойчива серая порошкообразная Форма с плотностью 5,8. Скорость перехода в нее обычного олоза очень мала.
Поэтому такой переход, сопровождающийся превращением оловянного предмета в серый порошок, при охлаждении олова обычно не присходит. Однако он наблюдается на некоторых старинных сосудах и медалях из олова.
Выше 161 °С олово переходит (при 200 °С уже довольно быстро) в модификацию с плотностью 6,6, характеризующуюся большой хрупкостью. Поэтому н гретое выше 200 °С олово можно легко растереть в мелкий порошок.
Под действием кислорода воздуха германий и олово не изменяются, а свинец окисляется. Поэтому свинцовые предметы не имеют блестящего металлического вида. Пленка окисла в обычных условиях хорошо предохраняет металлот дальнейшего окисления, но при нагревании оно идет дальше и свинец постепенно окисляется нацело. При нагревании на воздухе начинает окисляться и олово. Германий взаимодействует с кислородом лишь выше 700 °С. Все три элемента способны соединяться с галоидами и серой.
Вода не действует на германий и олово. Со свинца она постепенно снимает окисную пленку и тем способствует его дальнейшему окислению. В ряду напряжений Ge располагается между медью и серебром, a Sn и Pb передводородом. Лучшим растворителем свинца является разбавленная азотная кислота, герхмания и олова – царская водка. Взаимодействие с ней обоих элементов идет по схеме:
ЗЭ + 4HNO3 + 12НСl = ЗЭСl4 + 4NO + 8Н2 О
Все производные свинца сильно ядовиты.
3) Отношение элементов подгруппы германия к отдельным кислотам существенно различно. Соляная кислота не действует на германий. Олово лишь очень медленно растворяется в разбавленной НСl, тогда как с концентрированной легко (особенно при нагревании) идет реакция по уравнению:
Sn + 2HCl = SnCl2 + H2
Свинец при взаимодействии с НСl покрывается слоем труднорастворимого PbСl2 , препятствующим дальнейшему растворению металла. Аналогично идет взаимодействие свинца и с серной кислотой, однако лишь до тех пор, покаконцентрация ее не превышает 80%. При более высоких концентрациях H2 SO4 образуется растворимая кислая соль Pb(HSO4)2 уже не защищающая свинец от дальнейшего действия кислоты. На германий разбавленная серная кислота не действует, на Sn – почти не действует. В горячей концентрированной H2 SO4 оба элемента растворяются по схеме:
Э + 4H2 SO4 = Э(SО4 )2 + 2SO3 + 4Н2 О
При действии на Ge азотной кислоты образуется осадок гидрата двуокиси – хGеО2 ·Н2 О. Аналогично–по схеме Sn+ 4HNO3 = SnO2 + 4NO2 +2H2 O действует концентрированная азотная кислота и на олово. Напротив, в сильно разбавленной холодной HNO3 олово медленно растворяется с образованием Sn(NО3 )2 . Водород при этом не выделяется, а идет на восстановление азотной кислоты. При действии HNO3 на свинец, по реакции 3Pb + 8HNO3 = 3Pb(NO3 )2 + 2NO + 4H2 O образуется Pb(NО3 )2 . Соль эта нерастворима в концентрированной НNО3 и предохраняет металл от дальнейшего действия кислоты. Напротив, в воде она хорошо растворима, и поэтому в разбавленнойазотной кислоте свинец легко растворяется.
Растворы щелочей на германий почти не действуют. Олово и свинец медленно растворяются в сильных щелочах по схеме Э + 2NaOH = Na2 ЭO2 + H2 . Растворимостью олова в щелочах пользуются для снятия его со старых консервных банок, после чего металл выделяют из раствора электролитически. Ввиду высокой стоимости олова его регенерация (обратное получение) имеет большое экономическое значение.
Характерные для германия и его аналогов положительные валентности 4 и 2. Поэтому известны два ряда производных рассмагриваемых элементов, Для германия гораздо более типичны соединения, в которых он четырехвалентен. У олова различие Появляется менее резко, хотя при обычных условиях производные четырехвалентного Sn более устойчивы. Напротив, для свинца значительно более типичны соединения, в которых он двухвалентен. В связи с этим производные двухвалентных Ge и Sn являются восстановителями (притом очень сильными), а соединения четырехвалентного Pb – окислителями (также очень сильными). Но переход от более низкой к более высокой положительной валентности, как правило, легче идёт в щелочной среде, а обратный переход – в кислой. Поэтому восстановительные свойства двухвалентных Ge и Sn в щелочной среде выражены сильнее, чем в кислой, а четырехвалентный Pb, будучи очень сильным окислителем в кислой среде, в щелочной таковым не является.
Для элементов подгруппы германия известны окислы типов ЭО и ЭО2 . Первые называют обычно окисями, вторые – двуокисями. При накаливании на воздухе Ge и Sn образуются их в ы с–шие окислы, а при накаливании Pb – низший. Остальные могут быть получены лишь косвенным путем. Например, PbO2 обычно получают взаимодействием уксуснокислого свинца с хлорной известью по уравнению:
Pb(СН3 СОО)2 + Са(Сl)ОСl + Н2 О = PbО2 + СаСl2 + 2СН3 СООН
Все рассматриваемые окислы представляют собой твердые вещества, причем GeO и SnO характеризуются черной окраской, PbO – желтовато–красной, GeO2 и SnO2 –белой, PbО2 –темно–коричневой.
Так как с водой эти окислы почти не соединяются, отвечающие им гидроокиси обычно получают действием сильных щелочей на растворы соответсвующих солей, например:
SnCl4 + 4NaOH = 4NaCl + Sn(OH)4
Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2
Они выделяются в виде осадков белого – Sn(OH)4 , коричневого – Ge(OH)2 и бурого – Pb(OH)2 цветов.
По химическим свойствам все рассматриваемые гидроксиды представляют собой амфотерные соещинения.
Характерность того или иного направления диссоциации отдельных представителей видна из следующего сопоставления:

Наиболее отчетливо кислотные свойства выражены у гидрата двуокиси германия, который все же является очень слабой кислотой. Основные свойства наиболее отчетливо выражены у Pb(ОН)2 , который сообщает воде заметную щелочную реакцию.
Ввиду своего амфотерного характера рассматриваемые гидроокиси растворяются и в сильных щелочах и в кислотах. При действии на них щелочей образуются соли кислот типа Н2 ЭО3 или Н2 ЭО2 , содержащие Ge, Sn или Pb в составе аниона, а при действии кислот – соли этих элементов с катионами Э2+ или Э4+.
От гидрата PbОг, как кислоты, и Pb(ОН)2, как основания, производятся два смешанных окисла свинца – Pb2 Оз (т. н, закись–окись) оранжевого цвета и Pb3 О4 (т. н. сурик) ярко–красного цвета. Первый является свинцовой солью м ет асвинцовой (Н2 PbО3 ), второй – ортосвинцовой кислоты (Н4 PbО4 ). Таким образом, оба окисла – PbPbО3 и Pb2 PbО4 –содержат в своем составе атомы свинца различной валентности. В воде они практически нерастворимы.
Ввиду слабости основных свойств гидратов двуокисей Ge, Sn и Pb их производные с катионами Э4+ подвергаются в растворах сильному гидролизу. Наибольшее значение имеют галоге–ниды типа ЭГ4 , которые известны для всех рассматриваемых элементов и галоидов кроме PbВr4 и PbJ4 ).
По физическим свойствам они (кроме SnF4 и PbF4 ) напоминают скорее не типичные соли, а аналогичные соединения Si и С. Например, SnCl4 является бесцветной жидкостью (т. пл. –32 °С, т. кип. 114°С).
Самым характерным химическим свойством галогенидов ЭГ4 является их склонность к реакциям присоединения. Так, SnCl4 образует комплексы с Н2 О, NH3 , окислами азота, РСl5 и т. д., равно как со многими органическимивеществами. Весьма устойчивы комплексы большинства галогенидов ЭГ4 с галоидоводородными кислотами (главным образом типа H2 [ЭГ6 ]) и производные от подобных комплексных кислот соли. Например, раствор (NH4 )2 [SnCl6 ] показывает нейтральную реакцию на лакмус.
Соли кислородных кислот для двухвалентного олова (и германия) малохарактерны. Из них SnSO4 используется при электролитическом лужении (т. е. покрытии других металлов оловом). Подобно остальным производным Sn2+, сольэта ядовита.
В противоположность аналогичным соединениям олова соли двухвалентного свинца восстановителями не являются. Большинство их бесцветно и труднорастворимо в воде. Из часто встречающихся в практике хорошо растворяются 'только азотнокислая [Pb(NO3 )2 ] и уксуснокислая [Pb(СН3 СОО)2 ].
Отвечающие типам 3S и 3S2 сульфиды рассматриваемых элементов могут быть получены (кроме PbS2 ) как сухим путем (исходя из элементов), так и действием сероводорода на содержащие ионы Э2+или Э4+ растворысоответствующих солей. В последнем случае образуются осадки следующих цветов:
GeS2 – белый
SnS2 – желтый
GeS – буро–красный
SnS – бурый
PbS – черный
В воде и разбавленных кислотах рассматриваемые сульфиды практически нерастворимы. Исключение представляет GeS2 , слегка растворимый в воде и гидролитически разлагающийся ею. Сульфиды типов ЭS и ЭS2 существенно отличаются друг от друга по своему отношению к сернистому ахммонию. В то время как на первые он не действует, вторые переводятся им в раствор с образованием аммонийных солей тиогерманиевой (H2 GeS3 ) и тиооловянной (H2 SnS3 ) кислот по схеме:
(NH4 )2 S + 3S2 = (NH4 )2 ЭS3
Эти тиокислоты в свободном состоянии неустойчивы. Поэтому при подкислении растворов их солей происходит отщепление H2 S и осаждение сульфида ЭS2 :
(NH4 )2 ЭS3 + 2НСl – 2NH4 Cl + H2 S + ЭS2
Несколько особняком в химии Ge, Sn и Pb стоят их водородные соединения. Для двухвалентных элементов они не характерны. Для четырехвалентных устойчивость их в ряду Ge–Sn–Pb Уменьшается настолько быстро, что существование PbH4 могло быть только доказано (по летучести свинца при его соприкосновении с атомарным водородом), но в индивидуальном состоянии он не получен. Гидриды германия и олова образуются как незначительные примеси к водороду при разложении кислотами сплавов этих элементов с магнием. От водорода они могут быть отделены охлаждением смеси газов жидким воздухом.
По физическим свойствам GeH4 и SnH4 похожи на аналогичные соединения Si и С. Они также представляют собой бесцветные газы с низкими температурами плавления и кипения. При хранении гидриды германия и олова постепенно разлагаются на элементы. Оба они чрезвычайно ядовиты.
Оловянные кислоты, растворимые и нерастворимые в кислотах формы различают как α- и β-оловянные кислоты, или как «обычная оловянная кислота» и метаоловянная кислота». Последнюю непосредственно получают при обработке металлического олова концентрированной азотной кислотой.
Кажущееся растворение β-оловянной кислоты происходит в результате ее обработки концентрированной соляной кислотой с последующим сильным разведением. Однако при этом происходит не истинное растворение, а образование коллоидного раствора вследствие пептизации под влиянием соляной кислоты. Под действием концентрированной соляной кислоты (а также других сильных электролитов) β-оловянная кислота снова выпадает. Напротив, из раствора α-оловянной кислоты в концентрированной соляной кислоте можно отогнать тетрахлорид олова.
Помимо различного поведения в отношении кислот, α- и β-оловянные кислоты различаются также следующими реакциями: α-оловянная кислота легко растворима как в растворе карбоната калия, так и в растворе едкого кали любой концентрации; β-оловянная кислота в растворе карбоната калия не растворима. Она не растворима также в концентрированном едком кали. Если такой раствор разбавить, β-оловянная кислота переходит (коллоидно) в раствор. Из этого раствора не удается получить никакой кристаллической соли. Упариванием щелочных растворов β-оловянной кислоты получают аморфные вещества, которые прежде принимали за соли «метаоловянной кислоты» и называли «метастаннатами», однако в действительности эти вещества являются лишь продуктами адсорбции щелочи водного диоксида олова. Из солянокислых растворов (соответственно коллоидных растворов) сульфат калия или натрия осаждает на холоду только β-оловянную кислоту, но не α-оловянную кислоту. α-оловянная кислота в виде геля прочнее удерживает воду в связанном состоянии, чем β-оловянная кислота, и обладает большей адсорбирующей способностью, например, по отношению к фосфорной кислоте и органическим красителям, чем β-оловянная кислота.
Различные свойства обеих модификаций оловянных кислот были обнаружены еще Берцелиусом, который ввел в связи с этим в химию понятие изомерии.
Согласно Мекленбургу, существенные различия в поведении α- и β-оловянных кислот объяснить, если принять, что оба эти вещества являются различными коллоидными модификациями нерастворимой в воде диоксида олова или ее гидратов, которые различаются величиной своих частиц. Обычная оловянная кислота (α-оловянная кислота) состоит в соответствии с этим из сравнительно мелких частиц, β-оловянная кислота − из сравнительно крупных частиц (которые все же находятся за пределами разрешающей способности ультрамикроскопа). Такое представление базируется на непрерывности перехода одной формы в другую при старении гелей. В дальнейшем Мекленбург смог показать, что образующаяся при гидролизе сульфата олова(IV) при 0 °C оловянная кислота по своим свойствам приближается к α-оловянной кислоте; однако при повышении температуры реакции все более и более проявляются типичные свойства β-оловянной кислоты. Это подтверждает, что β-оловянная кислота состоит из более крупных частиц, так как в общем случае осаждение, идущее при нагревании, приводит к образованию более крупных частиц, чем на холоду. Однако сомнительно, чтобы различия между α- и β-оловянными кислотами обусловливались только различной величиной частиц. Вильштеттеру удалось получить, используя подходящии способы приготовления и высушивания, препараты, которые содержат SnO2 и Н2О в простых стехиометрнческих соотношениях и обнаруживают в широких температурных интервалах однородный состав. Наиболее активная модификация, осаждаемая аммиаком в присутствии хлорида аммония из растворов SnС14, при высушивании ацетоном в температурном интервале от −35 до −10 °С имеет приблизительный состав SnO2∙3Н2O. После обработки ацетоном при более высоких температурах она отдаст остальную воду достаточно непрерывно. Напротив, у препаратов, которые значительно дольше были в соприкосновении с водой, т. е. уже несколько «постарели» (и их растворимость в кислотах, прежде всего, в азотной и серной, уже отчетливо уменьшилась), при высушивании ацетоном было обнаружено постоянство содержания воды в интервале 0−15 °С при составе, приблизительно соответствующем 2SnO2∙3Н2O, и во второй раз в интервале 30−56 °С (температура кипения ацетона) при составе, соответствующем формуле 4SnО2∙5Н2O. На основании этого Вильштеттер заключил, что при «старении») происходит конденсация, т. е. соединение простых молекул в более сложные с отщеплением воды.
51. Общая характеристика элементов VА группы. Азот, структура и свойства простого вещества. Соединения азота в отрицательных степенях окисления. Соли аммония, их поведение при нагревании. Нитриды, классификация, получение и свойства
В главную подгруппу V-ой группы входят азот, фосфор, мышьяк, сурьма и висмут. Азот, фосфор и мышьяк являются неметаллами, сурьма и висмут – металлы. Согласно строению внешнего электронного слоя атомов это типичные р-элементы:
N [He]2s22p3,
P [Ne]3s23p33d0,
As [Ar]3d104s24p34d0,
Sb [Kr]4d105s25p35d0,
Bi [Xe]4f145d106s26p36d0.
Полными электронными аналогами являются As, Sb и Bi их атомы имеют одинаковую электронную конфигурацию внешнего n слоя и предыдущей (n-1)d оболочки. Однако потенциалы ионизации I5 столь велики, что простые ионы Э5+ для всех элементов главной подгруппы V-ой группы не существуют. Поэтому химические свойства Р, As, Sb и Bi определяются только строением внешнего электронного слоя. Три неспаренных электрона в основном и пять в валентно-возбуждённом состояниях позволяют этим элементам проявлять валентности III и V. Благодаря ns2-электронной паре и вакантному nd-подуровню валентность элементов может быть также IV и VI. У сурьмы и висмута в комплексных соединениях в виду больших размеров их атомов валентность может достигать VII и VIII, например, во фторидных комплексах K2[SbF7] и K3[BiF8].
Из-за отсутствия d-подуровня атом азота не может иметь возбуждённого состояния с пятью неспаренными электронами, поэтому его валентность в соединениях не превышает IV. Химические свойства азота очень сильно отличаются от свойств других элементов группы. Его малые по размеру валентные s- и p-орбитали способны образовывать гибридные sp3-, sp2- и sp-орбитали с высокой электронной плотностью. При этом, незадействованные в гибридизации р-орбитали, как и в случае атома углерода, могут участвовать в создании прочных -связей с атомами лёгких элементов (B, C, O, N), т.е. двойных и тройных связей. В ряде соединений -связи упрочняются за счёт почти полного перехода одного из s-электронов атома азота на соседний атом. Такое состояние азота с четырьмя неспаренными электронами можно обозначить как N+. Азот N+ способен образовывать четыре двухэлектронные связи по обменному механизму с атомами O, C и N, например, в НNO3, HN3, HCNO и др., где степень окисления азота формально +5. Соединения азота(+5) отличаются по химическим свойствам от аналогичных соединений фосфора и мышьяка.
Высокие значения электроотрицательности элементов (табл.1) позволяют объяснить отрицательные степени окисления в соединениях с более электроположительными элементами, и положительные степени окисления в соединениях с более электроотрицательными элементами:
N 3, 2,1, 0, +1, +2, +3, +4, +5;
P 3, 2, 0, +1, +3, (+4), +5;
As 3, 0, +3, +5;
Sb, Bi 3, 0, +3, (+4), +5.
Устойчивость соединений в низших степенях окисления падает в группе от азота к висмуту, а устойчивость соединений в степени окисления +5 уменьшается при переходе от фосфора, как к азоту, так и к висмуту. Соединения азота(+5) и висмута(+5) сильные окислители.
Простое вещество азот (диазот) N2, бесцветный газ (tкип=195,80С, tпл.=2100С), без запаха и вкуса, малорастворимый в воде (23 мл в 1 л холодной воды).
Наличие вакантных -разрыхляющих орбиталей определяет -акцепторную способность азота, проявляющуюся в образовании комплексных соединений, например, [Ru(N2)(NH3)5]2+ , [Ru2(-N2)(NH3)10]4+. В этих комплексах молекула N2 является лигандом. Неподелённая пара электронов азота образует донорно-акцепторную -связь, а заполненные d-орбитали иона металла участвуют в образовании -дативной связи с вовлечением -разрыхляющих орбиталей молекулы азота. Таким образом, кратность связи металла с N2 может быть равной 2 и даже 3.
Прочность и неполярность молекулы N2, близость энтальпии ионизации молекулы (1402 кДж/моль) к энтальпии ионизации аргона объясняют её химическую инертность по отношению к многим веществам. В обычных условиях азот используют для создания инертной атмосферы вместо более дорогих благородных газов. Азот проявляет очень слабые восстановительные и окислительные свойства (энергия сродства к электрону 3,6 эВ). При комнатной температуре он реагирует только с литием. В случае инициирования реакций нагреванием, электрическим разрядом или ионизирующими излучениями, а также в присутствии катализаторов, азот взаимодействует с сильными окислителями и восстановителями:
N2 + O2 2NO (в электрическом разряде),
N2 + 6Li 2Li3N (при обычной температуре),
N2 + 2Ti 2TiN (при t=12000С),
N2 + 3H2 2NH3 (при 4005000С, катализатор).
В промышленности азот получают фракционной перегонкой жидкого воздуха, а в лаборатории термическим разложением нитрита аммония или нагреванием смеси насыщенных растворов нитрита натрия и хлорида аммония:
NH4NO2 N2 + 2H2O,
NaNO2 + NH4Cl N2 + NaCl + 2H2O.
Особо чистый азот получают разложением азида натрия при t=2750C:
2NaN3 2Na + 3N2.
Азот используется главным образом для получения аммиака, а также в качестве инертного газа в системах, где отсутствуют сильные восстановители или растворы комплексов переходных металлов. Жидкий азот широко используется для создания низких температур 1950С, при обезвреживании взрывных устройств и для тушения особых категорий пожаров.
Соединения азота в отрицательных степенях окисления. Основными соединениями азота, в которых он проявляет отрицательные степени окисления, являются
3 2 1
