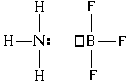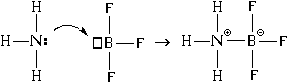- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5 atom бора – зоммерфельда
- •Вопрос 5
- •Вопрос 6
- •Решение уравнения Шредингера для атома водорода (и водоро-доподобных атомов).
- •5.1. Уравнение Шредингера для атома водорода.
- •7. Электронная конфигурация атома. Правила заполнения электронных оболочек атомов.
- •11. Радиусы атомов и ионов. Орбитальные и эффективные радиусы. Изменение атомных и ионных радиусов в периодах и группах п.С. Эффекты d- и f-сжатия.
- •12. Энергия сродства к электрону. Факторы, определяющие величину сродства к электрону. Изменение величин сродства по периодам и группам Период.Сис.
- •13. Ионизационный потенциал и энергия ионизации. Факторы, определяющие величину ионизационного потенциала. Изменения величин ионизационного потенциала по периодам и группам на примере 5 группы.
- •№19. Донорно-акцепторная связь.
- •№22 Метод молекулярных орбиталей.
- •№23. Ионная связь.
- •№24. Теория поляризации.
- •28. Влияние температуры на скорость химических реакций. Энергия активации. Факторы, влияющие на энергию активации.
- •31.Химическое равновесие. Константа хим. Равновесия. Сдвиг химического равновесия
- •32. Растворы, образование растворов. Электролитическая диссоциация. Механизм диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
- •33. Растворимость веществ. Влияние различных факторов на растворимость. Растворение как физико-химический процесс.
- •1).Давление
- •2).Температура
- •34. Силтные и слабые электролиты. Активность ионов. Равновесие в растворах слабых эликтролитов. Связь константы и степени диссоциации.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель. Определить pH 0,1 м раствора гидроксида калия и 0,01 м раствора серной кислоты.
- •36.Гидролиз солей. Типы гидролиза солей. Константа гидролиза. Влияние различных факторов на гидролиз.
- •Аммиак (nh3), гидразин (n2h4), гидроксиламин (nh2oh)
- •55. Общая характеристика VI а группы периодической системы. Сера, селен и теллур, свойства простых веществ. Изменение свойств в рядах гидроксосоединений в степенях окисления (IV) и (VI).
- •Пероксид водорода
- •Производство серной кислоты
- •Химические свойства
- •59. Общая характеристика подгруппы галогенов. Нахождение в природе, получение. Изменение физических и химических свойств в ряду простых веществ галогенов общая характеристика
- •Медь и её соединения
- •Химические свойства
- •Серебро и его соединения
- •Золото и его соединения
- •Цинк и его соединения
- •Кадмий и его соединения
- •Ртуть и ее соединения
- •1. Общая характеристика подгруппы хрома
- •Соединения хрома Соединения двухвалентного хрома
- •Соединения трёхвалентного хрома
- •Соединения шестивалентного хрома
- •Краткая характеристика триады железа
- •2.2) Физические свойства кобальта
- •2.3) Физические свойства никеля
- •3) Химические свойства элементов
№19. Донорно-акцепторная связь.
Разновидность ковалентной химической связи между атомами или группами атомов, возникающая за счет неподеленной электронной пары одной молекулы и свободной орбитали другой.
Донором называется частица, предоставляющая для связи двухэлектронное облако. Акцептор – частица со свободной орбиталью, принимающая эту электронную пару.
По свойствам донорно-акцепторная связь одинакова с остальными ковалентными связями, отличен лишь способ ее образования.
Рассмотрим донорно-акцепторный механизм на примере взаимодействия молекулы аммиака с молекулой трифторида бора:
У атома азота в молекуле аммиака после образования связей с атомами водорода остается еще одна валентная орбиталь с неподеленной парой электронов (в структурной формуле обозначена точками). У атома бора в молекуле трифторида бора после образования связей с атомами фтора остается одна свободная валентная орбиталь (в структурной формуле обозначена квадратиком). Неподеленную пару валентных электронов атом азота может предоставить атому бора " в совместное использование" , " поделиться" с ним этой электронной парой. При этом электроны бывшей неподеленной пары становятся общими для атомов азота и бора, то есть между ними образуется ковалентная связь. Но при этом у атомов бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у атома азота:
В результате между атомами азота и бора возникает и ковалентная, и ионная связь. При этом атом азота является донором электронной пары (" дает" ее для образования связи), а атом бора – акцептором (" принимает" ее при образовании связи). Отсюда и название механизма образования такой связи – " донорно-акцепторный».
Валентность (способность к образованию химических связей) бора в BF3 и BF4 равна 3, как и валентность азота в NH3 и NH4+ также равна 3.
Донорно-акцепторное взаимодействие лежит в основе каталитических процессов, проявляется в первичных актах многих химических процессов, обуславливает сольватацию (комплексы жидких растворов, частицы вещества которого связаны с частицами растворителя) молекул и ионов в растворах, может приводить к образованию новых соединений. №20. Метод валентных связей. Теория возникла стараниями ученых: Гайтлера, Лондона, Полинга и Слетера. Согласно теории каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких электронных пар. Причем, связь является двухцентровой и двухэлектронной. Положения теории: связь образуется двумя электронами с противоположными спинами. Между ядрами атомов сконцентрирована максимальная электронная плотность. Связь направлена в сторону максимального перекрывания электронных облаков. Атомы не теряют своей индивидуальности при образовании связей. Структуру любой молекулы можно представить графически, обозначив связи черточками, в итоге получается валентная схема. Для сложных молекул возможно несколько схем, истинной является совокупность всех их наложений. Ковалентная связь имеет характерные особенности: направленность, насыщенность и полярность.
№ 21. Гибридизация. Теория принадлежит Полингу. При образовании молекул может происходить изменение формы и энергии исходных орбиталей валентных электронов и формирование на их основе того же числа одинаковых по форме и энергии гибридных орбиталей. Как физический процесс гибридизация не существует. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметричного распределения электронной плотности в молекуле. Химическая связь с участием электрона гибридной орбитали прочнее. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственное расположенеие и конфигурацию молекул. Условия устойчивой гибридизации:
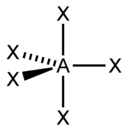
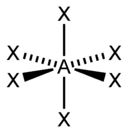
Типы гибридизации: sp-гибридизация образуется при смешении s- и p-орбитаелий, образуя две гибридные, линейная форма, 180 градусов; sp2-гибридизация образуется из одной s-орбитали и двух p- орбиталей, образуя три гибридные орбитали, треугольная(плоская) форма, 120 градусов; sp3-гибридизация образуется при смешении одной s-орбитали и трех p-орбиталей, образуя четыре гибридные, тетраидэр, 109 градусов. В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Искажение валентных углов углов в этом случае вызывается взаимным отталкиванием связывающих и несвязывающих электронных пар центрального атома. Однако следует учесть, что облако связывающей электронной пары занимает меньше места, чем облако несвязывающей. Следовательно наибольший эффект отталкивания между несвязывающими парами, несколько меньший между связывающей и несвязывающей и, наконец, наименьший – между двумя связывающими. С увеличением числа несвязывающих электронов центрального атома изменяется и пространственная конфигурация молекул. Диоксид серы имеет sp2-гибридизацию, плоскую форму молекулы. Ион оксида серы имеет sp3-гибридизацию и геометрическую форму – тригональная пирамида. Фосфин имеет sp3-гибридизацию, также тригональная пирамида.
|
|||||||||||||||||||||||||||||||||||||
|