
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
36 Технологическая схема производства аммонийной селитры в ас-72
Создано несколько схем производства аммонийной селитры, которые отличаются по концентрации азотной кислоты. Используются крупнотоннажные агрегаты АС-67,АС-72, которые отличаются в компоновке оборудования. Основным отличием схемы АС-72 является использование спецнасосов, которые позволяют перекачивать расплав 1800С.

Азотная кислота (58-60%) поступает в подогреватель 3, нагревается до 800С. Газообразный аммиак нагревается в подогревателе 4 конденсатом пара из аппарата ИТН до 1300С. Для получения аммонийной селитры с улучшенными физико-механическими свойствами вводят серную (0,2-0,3%) и фосфорную кислоты (0,3-0,5%P2O5). Аппарат ИТН 5 представляет собой два концентрически расположенные вертикальные цилиндра. Во внутреннем цилиндре происходит реакция нейтрализации азотной кислоты аммиаком при 150-1600С. Образовавшийся раствор нитрата аммония переливается через верхний край цилиндра в испарительную часть аппарата – в кольцевое пространство между цилиндрами. Здесь раствор упаривается за счет тепла нейтрализации и вытекает через гидравлический затвор и сепаратор. Соковый пар проходит очистные тарелки, используется для подогрева азотной кислоты и выбрасывается в атмосферу. Для уменьшения потерь связанного азота с соковым паром процесс нейтрализации ведут в слабокислой среде, т.кпри избытке азотной кислоты давление пара кислоты над раствором нитрата аммония меньше, чем давление аммиака при его избытке в растворе. Во избежание коррозии выпарных аппаратов и потерь азота вытекающий из аппарата ИТН раствор донейтрализуют аммиаком в донейтрализаторе 6. Раствор подается в комбинированный выпарной аппарат 8, состоящий из 3-х частей: трубчатой, массообменной, очистной. Для интенсификации на стадии выпарки подают горячий воздух. Далее плав поступает на грануляцию в грануляционную башню 14.В верхней части башни расположены 3 статических виброгранулятора леечного типа 13. Падающие капли плава охлаждаются встречным потоком воздуха, просасываемого через хвостовые вентиляторы 20, и кристаллизуются в форме гранул размером 1-3мм. Гранулы через отверстие в конусном днище башни попадают на транспортер. Охлаждают в охладителе «кипящего слоя» 18. Для предотвращения слеживаемости селитру подают во вращающийся барабан 19, подают антислеживающие добавки либо припудривают тальком. Для очистки воздуха по боковым частям башни устанавливают 6промывных скрубберов 15.
37. Физико-химические основы процесса синтеза
Карбамид (мочевина) (NH2)2СО представляет собой амид карбаминовой кислоты Н2СООН. Структурная формула карбамида приводится на рисунке 5.1
NH2
/
О = С
\
NH2
Рисунок 5.1
Данные, характеризующие физико-химические свойства карбамида:
- плотность при 25 °С 1330 кг/м3
- молекулярная масса 60,056 кг/кмоль
- температура плавления при атмосферном
давлении 132,7 °С
- удельная теплоемкость при 20 °С 1,35 кДж/г
- теплота плавления 242 Дж/г
- теплота образования из простых веществ 6333,5 кДж/моль
- теплота растворения в воде 242 Дж/г
Качество выпускаемого приллированного карбамида с кондиционирующими добавками и без добавок должно соответствовать требованиям ГОСТ 2081-92 марки Б высшего сорта, которые представлены в таблице 5.2.
Таблица 5.2
|
Нормы для марки |
||||
Наименование показателей |
А |
Б |
|||
|
Высш. сорт |
1-й сорт |
Высш. сорт |
1-й сорт |
2-й сорт |
1. Массовая доля азота в пересчете на сухое вещество, % не менее |
46,3 |
46,2 |
46,2 |
46,2 |
46,2 |
2. Массовая доля биурета, % не более |
0,6 |
1,4 |
1,4 |
1,4 |
1,4 |
для карбамида кристаллического приллированного |
0,01 0,02 |
0,01 0,02 |
- - |
- - |
- - |
метод высушивания метод Фишера |
0,3 0,6 |
0,3 0,6 |
0,3 0,5 |
0,3 0,5 |
0,3 0,6 |
5. Рассыпчатость, % |
- |
- |
100 |
100 |
100 |
массовая доля гранул размером, мм от 1 до 4, не менее от 2 до 4, не менее менее 1, не более |
- - - |
- - - |
94 70 отсут. |
94 50 отсут. |
94 - отсут. |
7. Статическая прочность гранул, кгс/гранулу, не менее |
- |
- |
0,7 |
0,5 |
0,3 |
Особенностью технологического процесса фирмы "Стамикарбон" является разложение карбамата аммония, непрореагировавшего в карбамид, при давлении в стадии синтеза, путем тепловой обработки раствора, выходящего из реактора, в токе свежего диоксида углерода – так называемый стриппинг процесс.
Контур высокого давления в технологической схеме предложенной фирмой "Стамикарбон" включает в себя реактор для образования карбамида, узел стриппинга - дистилляции (стриппер и карбаматный конденсатор) и узел промывки инертных, по отношению к реакции синтеза, газов от аммиака и диоксида углерода (скруббер).
Большая часть, из не прореагировавших в колонне синтеза (реакторе), аммиака и диоксида углерода отгоняется из плава синтеза при температурной обработке в токе свежего диоксида углерода в стриппере. Газовую фазу из стриппера, поступающую в карбаматный конденсатор, полностью не конденсируют с целью использования тепла выделившегося при образовании карбамата, в реакторе при синтезе карбамида. Образующаяся газожидкостная смесь поступает в реактор, который работает при давлении не более 14,1 МПа. Плав синтеза из реактора подается в стриппер, и контур замыкается. Карбамид получают взаимодействием аммиака и диоксида углерода по следующим реакциям:
- образование карбамата аммония
2 NН3 + СО2 NН2СООNН4 + 157,84 КДж/моль
(37,70 Ккал/моль)
- его дегидратация
N Н2СООNН4 NН2СОNН2 + Н2О - 15,78 КДж/моль
(3,70 Ккал/моль)
Для смещения равновесия экзотермической реакции вправо к образованию карбамата процесс проводится в конденсаторе под давлением синтеза и с избытком аммиака. Реакция превращения карбамата в карбамид - эндотермическая и проводится при температуре 183°С в реакторе.
При оптимальном ведении технологического режима степень конверсии диоксида углерода в карбамид достигает проектной величины - 57 %.
Обе реакции являются обратимыми, состояние равновесия определяется условиями, при которых проводится синтез карбамида и зависит от ряда факторов: температуры, давления, плотности загрузки аппарата (степени его заполнения), соотношения между аммиаком и углекислым газом, количества воды, вводимой с исходными реагентами в реактор, времени пребывания реагентов в зоне реакции.
Обе реакции являются обратимыми, состояние равновесия определяется условиями, при которых проводится синтез карбамида и зависит от ряда факторов: температуры, давления, плотности загрузки аппарата (степени его заполнения), соотношения между аммиаком и диоксидом углерода, количества воды, вводимой с исходными реагентами в реактор, времени пребывания реагентов в зоне реакции.
Рассмотрим влияние плотности заполнения реактора на состояние равновесия вышеописанных реакций. Возрастание плотности заполнения реактора приводит к увеличению выхода карбамида. Поскольку карбамид образуется в основном в жидкой фазе, то, чем больше плотность заполнения, тем меньше объем газовой фазы и меньшее количество карбамата аммония переходит в виде аммиака и диоксида углерода в газовую фазу. Зависимость степени превращения карбамата аммония в карбамид от степени заполнения реактора приводится на рисунке 5.2
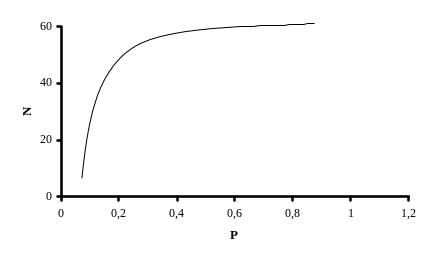
Рисунок 5.2
где N - степень превращения карбамата аммония в карбамид (выход), %;
Р - плотность заполнения реактора, г/см3.
Примечание: результаты получены при температуре 170 °С.
Рассмотрим влияние воды, вносимой с исходными реагентами, а также образующейся в ходе реакции дегидратации карбамата аммония на состояние равновесия. Образующаяся в результате реакции вода в начале процесса положительно влияет на выход карбамида, снижая температуру плавления карбамата аммония, что способствует образованию жидкой фазы. По мере накопления воды в системе равновесие реакции начинает сдвигаться влево, т.е. уменьшается выход карбамида. Следовательно, избыток воды необходимо выводить из зоны реакции, чтобы сдвинуть равновесие реакции в сторону образования карбамида. Это достигается подачей в колонну синтеза избыточного (от стехиометрического соотношения) количества аммиака, который связывает воду. Зависимость равновесной степени превращения карбамата аммония в карбамид от количества свободной воды приведена на рисунке 5.3
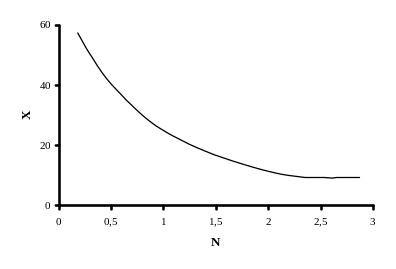
Рисунок 5.3
где N - число молей Н2О на 1 моль карбамата аммония;
Х - равновесная степень превращения карбамата аммония в карбамид (выход), %.
Примечание: данные получены при температуре от 150 °С до 160 °С и плотности заполнения реактора от 0,5 до 0,9 г/см3.
Рассмотрим влияние давления на состояния равновесий реакций образования карбамата аммония из диоксида углерода и аммиака, и его последующей дегидратации. Давление оказывает значительное влияние на скорость образования карбамата аммония. Скорость образования карбамата аммония возрастает пропорционально квадрату давления. При нормальной температуре и атмосферном давлении скорость образования карбамата аммония очень мала, а при давлении 10,0 МПа (100 кгс/см2) и температуре 150 °С реакция протекает мгновенно. Так как реакция образования карбамида равновесная, и раствор из реактора содержит еще значительное количество не прореагировавших аммиака и диоксида углерода, то очень важно быстро удалить аммиак и диоксид углерода, чтобы максимально ограничить процесс гидролиза карбамида. Стриппинг раствора диоксидом углерода позволяет ограничить процесс гидролиза, тем более что давление в узле синтеза фактически определяется количеством диоксида углерода и аммиака, которые содержатся в выходящем растворе из реактора.
Несмотря на стриппинг диоксидом углерода, его концентрация в растворе, выходящего из стриппера, снижается. Причина кроется в разложении карбамата, для чего и производится термическая обработка раствора в стриппере. Чем больше разница в концентрациях аммиака в жидкой и газовой фазах, тем быстрее протекает процесс стриппинга. Вот почему в данном процессе используется принцип противотока реакционной массы и свежего диоксида углерода, который позволяет эффективно производить удаление аммиака. Зависимость выхода карбамида от давления в системе приводится на рисунке 5.4
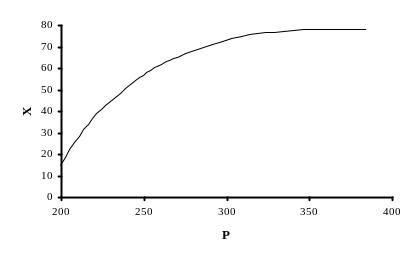
Рисунок 5.4
где Х - выход карбамида, %;
Р - давление, МПа (кгс/см2).
Рассмотрим влияние температуры на состояния равновесий реакций образования карбамата аммония из диоксида углерода и аммиака, и его последующей дегидратации. С повышением температуры равновесие реакции сдвигается в сторону образования карбамида, что иллюстрируется на рисунке 5.5
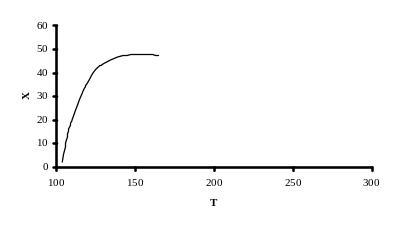
Рисунок 5.5
где Т - температура, °С;
Х - выход карбамида, %.
Примечание: результаты получены при плотности заполнения реактора 1,0 г/см2.
Однако, влияние температуры на равновесие невелико: при температуре 140°С степень конверсии диоксида углерода в карбамид составляет 43 %, а при повышении температуры до 190 °С выход увеличивается на 6,8 %. Более значительное влияние оказывает изменение температуры на скорость дегидратации карбамата аммония. Зависимость скорости дегидратации карбамата аммония от температуры приводится на рисунке 5.6
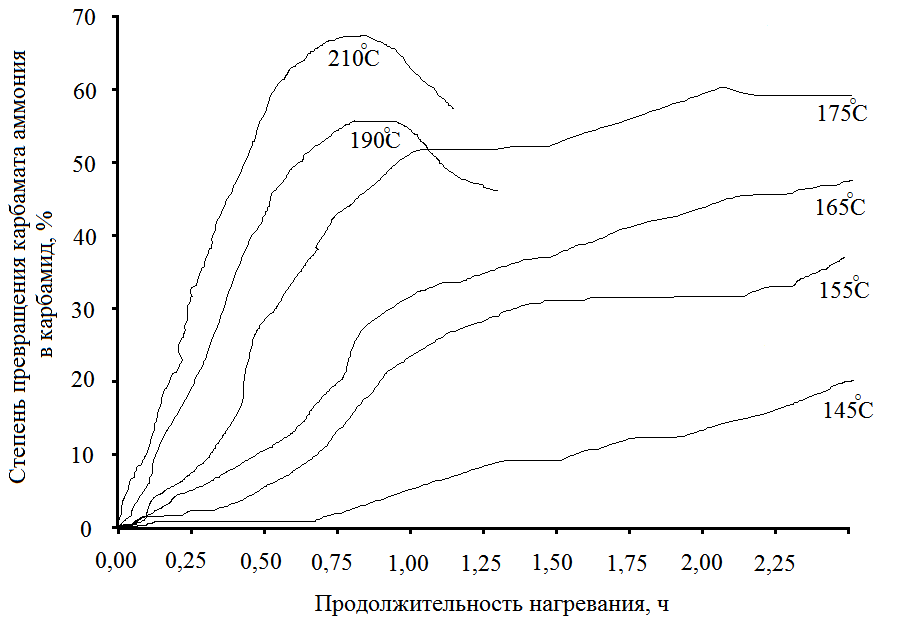
Рисунок 5.6
где С - выход карбамида по диоксиду углерода от теоретического;
Т - время.
Примечание: результаты получены при соотношении NН3 : СО2 = 2.
Повышение температуры значительно увеличивает скорость реакции. При 155°С предельная скорость реакции достигает через 4 часа; при 170 °С - через 2 часа; при 180 °С - через 1,5 часа.
