
- •Соединения азота
- •2. Физико-химические основы и аппаратурное оформление процессов высокотемпературной фиксации атмосферного азота.
- •Термический метод
- •3 Теоретические основы получения низких температур
- •4Теоретические основы криогенной техники. Холодильные циклы. Технологические схемы н оборудование воздухе разделительных установок.
- •5. Теоретические основы разделения жидкого воздуха на азот и кислород. Устройство ректификационной установки.
- •7.Обзор и сравнение способов получения водорода
- •8 Газификация твердого топлива
- •9. Конверсия водяным паром
- •10. Основы конверсии природного газа кислородом и смесью окислителей. Оптимальный температурный режим.
- •11. Методы очистки газов от каталитических ядов. Очистка природного газа от сернистых соединений.
- •12.Технологическая схема 2-х ступенчатой каталитической конверсии природного газа под давлением 3-4 мПа.
- •13 Типовое оборудование стадии конверсии:
- •14.Устройство конверторов оксида углерода. Полочные, аксиальные и радиальные конверторы.
- •Аксиальный двухполочный конвертор.
- •Радиальный двухполочный конвертор.
- •17. Очистка конвертируемого газа от со2
- •Очистка конвертируемого газа р-рами на основе водных этанол-аминов.
- •Очистка конвертируемого газа водными р-рами карбонатов щелочных Ме
- •18. Физико-химические основы синтеза nh3. Равновесие и кинетика процесса. Виды катализаторов.
- •19. Обоснование оптимального режима синтеза аммиака
- •20. Промышленые способы синтеза амиака.Принцип.Схемы
- •21. Технологическая схема синтеза аммиака в агрегатах большой единичной мощности
- •22 Устройство колонны синтеза аммиака с полочной насадкой.
- •24 Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режим.
- •26. Абсорбция оксидов азота осуществляется водой:
- •27Промышленые способы получения азотной кислоты
- •29. Методы обезвреживания хвостовых нитрозных газов в производстве азотной кислоты
- •30 Способы получения концентрированной азотной кислоты. Технологическая схема получения концентрированной азотной кислоты методом выпарки с водоотнимающимисредствами.
- •31. Прямой синтез конц. Hno3 из оксида азота
- •32.Вида азотных удобрений
- •Сульфат аммония
- •Аммонийной селитры
- •Карбамид
- •34. Физико-химические основы нейтрализации азотной кислоты аммиаком. Аппаратурное оформление процесса. Устройство оборудования.
- •35.Выпарка растворов аммиачной селитры. Гранулирование плава аммиачной селитры. Устройство основного оборудования.
- •36 Технологическая схема производства аммонийной селитры в ас-72
- •37. Физико-химические основы процесса синтеза
- •39.Технологическая схема карбамида с полным жидкостным рециклом.
- •40Технологическая схема производства карбамида (стрипинг процесс)
26. Абсорбция оксидов азота осуществляется водой:
3NO2+H2O = 2HNO3+NO+Q
Это суммарное уравнение, оно не отражает настоящего механизма процесса.
Реакция обратимая, экзотермическая и сопровождается уменьшением обьема и выделением вторичного оксида азота.
2NO2+H2O = 2HNO3+HNO2+Q
N2 O4+H2O = HNO3+HNO2
N2O3+H2O = 2HNO2
Все оксиды азота (кроме NO) взаимодействуют с водой. Азотистая кислота неустойчивое соединение, существует при низких температурах в разбавленных растворах. В реальных условиях:
3HNO2=2HNO3+2NO+ H2O
2NO2+H2O = 2HNO3+HNO2
3HNO2=HNO3+2NO+ H2O
3NO2+H2O = 2HNO3+NO
За один цикл в азотную кислоту превращается 2/3 NO2 , а 1/3 выделяется в газовую фазу в виде NO.
2NO+О2=2NO2
Процесс абсорбции должен сопровождаться окислением вторичного оксида азота. Общее количество NO в первом цикле 1 моль, во втором – 2/3 моль, в третьем- 1/3*2/3 моль. Нужны такие условия, чтобы одновременно с окислением вторичного оксида азота происходила абсорбция NO(маленькая температура и повышенное давление).
Движущая сила абсорбции с увеличением давления и уменьшением температуры будет уменьшаться. Движущей силой является разность концентраций NO2 в газовой фазе – концентрации NO2 над HNO3.
Чтобы увеличить движущую силу надо увеличить концентрацию NO2 в г.ф. и уменьшать равновесное порциальное давление NO2 над HNO3. Эти условия совпадают с условиями окисления NO2, следовательно, процессы можно вести в одном аппарате.
По мере протекания абсорбции С(HNO3) увеличивается, увеличивается и давление оксидов азота, а движущая сила процесса уменьшается(когда становится =0 абсорбция прекращается). Получить 100% HNO3 при абсорбции оксида азота водой невозможно.
3NO2+H2O = 2HNO3+NO+136,2кДж
Кр= (Р NO2*Р2 HNO3)/Р3 NO2*Р H2O
К1= Р NO2/ Р3 NO2 , К2= Р2 HNO3/ Р H2O
Кр=К1*К2, К1 и К2 зависят от температуры и концентрации HNO3, а Кр – только от Т. К2 определяется по давлению паров над HNO3, а К1 по порциальному давлению оксида азота над HNO3. Зная Кр и состав исходного нитрозного газа можно рассчитать равновесную степень превращения оксида азота при любых значениях температуры и концентрации HNO3. По мере протекания процесса концентрация NO2 уменьшается.
С увеличением температуры и концентрации HNO3 степень превращения оксида азота в азотную кислоту резко уменьшается. При концентрации HNO3>60% степень превращения почти = 0. Т.е поглощение оксида азота прекращается, т.к. резко уменьшается движущая сила процесса. При абсорбции оксида азота водой нельзя получить азотную кислоту с концентрацией >65%. Нельзя добиться полного поглощения оксида азота, т.к. всегда выделяется вторичный оксид азота.
3NO2+H2O = 2HNO3+NO
В отходящих газах всегда есть какое-то количество оксидов азота, значит нужно обезвреживать.
27Промышленые способы получения азотной кислоты
Наиболее распространенный способ получения азотной кислоты является абсорбция оксидов азота водой.
2NO2 + H2O = HNO3 + HNO2; 3HNO2 = HNO3 + 2NO + H2O; Σ: 3NO2 + H2O = 2HNO3 + NO + Q.
р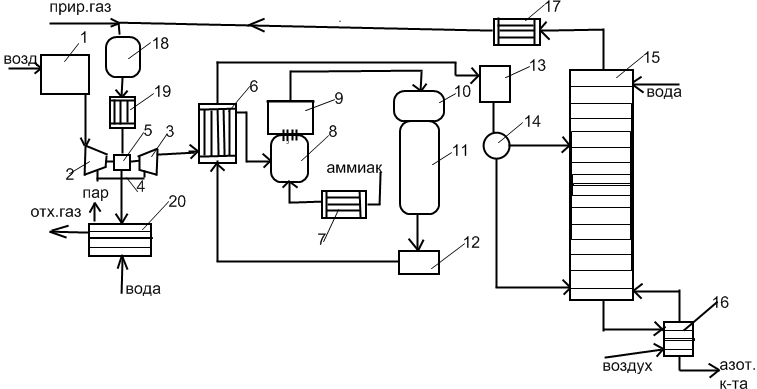 еакция
является ОВР, обратимой с выделением
тепла. С увеличением равновесного
парциального давления увеличивается
концентрация кислоты и увеличивается
температура, что приводит к прекращению
абсорбции. С увеличением давления
увеличивается поверхность контакта
ж-г, увеличивается скорость абсорбции.
В этом процессе лимитирующая стадия
окисление NO
до NO2.
Используют тарельчатые колонны с
ситчатыми тарелками (диаметр отверстий
2мм, расстояние между тарелками 1-1,2м,
высота колонны 45-50м). основным фактором
интенсификации является давление. В
выхлопных нитрозных газах всегда
присутствует NO.
Способы очистки: абсорбционный,
адсорбционный и каталитический.
Технологическая схема под повышенным
давлением (0,716МПа):
еакция
является ОВР, обратимой с выделением
тепла. С увеличением равновесного
парциального давления увеличивается
концентрация кислоты и увеличивается
температура, что приводит к прекращению
абсорбции. С увеличением давления
увеличивается поверхность контакта
ж-г, увеличивается скорость абсорбции.
В этом процессе лимитирующая стадия
окисление NO
до NO2.
Используют тарельчатые колонны с
ситчатыми тарелками (диаметр отверстий
2мм, расстояние между тарелками 1-1,2м,
высота колонны 45-50м). основным фактором
интенсификации является давление. В
выхлопных нитрозных газах всегда
присутствует NO.
Способы очистки: абсорбционный,
адсорбционный и каталитический.
Технологическая схема под повышенным
давлением (0,716МПа):
1 – фильтр для очистки воздуха; 2 – 1-ая ступень турбокомпрессора; 3 – 2-ая ступень турбокомпрессора; 4 – промежуточный холодильник; 5 – газовая турбина; 6 – подогреватель воздуха; 7 – подогреватель аммиака; 8 – смеситель; 9 – фильтр для дополнительной очистки АВС; 10 – контактный аппарат для окисления аммиака; 11 – котел-утилизатор; 12 – окислитель NO; 13 – холодильник-конденсатор; 14 – сепаратор; 15 – абсорбционная колонна; 16 – отбелочная колонна; 17 – теплообменник для подогрева нитрозных газов; 18 – топка; 19 – аппарат для каталитического восстановления NO; 20 - котел-утилизатор.
Очистка и сжатие воздуха, смешение с аммиаком, подогрев, окисление. Воздух поступает на 2-ухступенчатый турбокомпрессор: до 0,35МПа, 170-175˚С, поступает в промежуточный теплообменник, где отводится теплота; до 0,716МПа, 135˚С. Сжатый воздух поступает в подогреватель (т.к. окисление при 900˚С), где подогревается нитрозными газами с температурой 250-270˚С. В смесителе смешивается с аммиаком, при этом концентрация 11-11,5%. АВС проходит дополнительную фильтрацию и поступает в контактный аппарат. Окисление осуществляется на платиновом катализаторе (16 сеток). Температура окисления 900-920˚С, выход NO 95-96%. Нитрозные газы подвергаются охлаждению для последующего окисления. Котел-утилизатор 260˚С, полый аппарат-окислитель, содержание NO2 80% (темп. 300˚С). Затем поступают в подогреватель воздуха. После окислителя поступают в Холодильник-конденсатор, где охлаждаются до 50-70˚С. Смесь поступает в сепаратор, где отделяется азотная кислота от нитрозных газов. Кислота поступает в колонну на соответствующую тарелку, нитрозные газы под нижнюю тарелку, вода на верхнюю тарелку. В колонне происходит абсорбция и окисление NO. Кислота способна растворять оксиды азота, поэтому кислота подается в отбелочную колонну. Концентрация кислоты 56-58%. Степень поглощения оксидов азота 99,3%. Остаточная концентрация оксидов азота 0,1%, обезвреживание их осуществляют путем восстановления природным газом на алюмо-платиновом катализаторе, 700-800˚С. Остаточное содержание снижается до 0,002-0,005%. Утилизация энергии хвостовых нитрозных газов осуществляется в газовых турбинах, которые установлены на одном волу с компрессором.
28. АК – 72.
Мощность 1150 т/сутки. Р = 0.4 МПа окисл., Р = 1.1 МПа на стадии абсорбции.

1-фильтр для очистки воздуха;2-компрессор;3-испаритель ж. NH3;4-фильтр для очистки NH3;5-подогреватель NH3;6-смеситель NH3 с воздухом;7-фильтр для дополнительной очистки аммиачно-воздушной смеси;8-кат-ые сетки;9-котел-утилизатор;10-т/о для подогрева пит. воды 9;11-холод.-конд.;12-промывная колонна нитрозного газа13-сборник HNO3;14-циркул. насос;15-холодильник;16-компрессор для сжатия нитрозных газов;17-холод.-конд.;18-абсорбционная колонна;19-сборник HNO3;20-насос;21-отбелочная колонна;22-сборник продукц. HNO3;23-брызгоуловитель;24-т/о для подогрева хвостовых нитрозных газов;25-топка (смеситель) хвостовых газов с природным;26-ап. для каталитического восстан. ок. ;27-г. турбина.
Воздух перед подачей в аппарат подвергается очистке от механических примесей путём фильтрации воздуха сжимая до Р=0.45 МПа и в смеситель, туда и NH3. NH3 проходит испаритель (0.6 МПа), очистку от механических примесей, подогрев до 150 °С. Воздух нагревается до 160°С -170°С за счет сжатия. Подогрев надо, т. к. теплоты реакции недостаточно для поддержания оптимального режима. Токисл.=840-860°С. Воздух смешивается с NH3. Концентрация NH3 в см. =10% (поддерживается автоматически). В смесителе дополнительная фильтрация (чтобы кат. служил больше). Допустимое содержание примесей 0.007 мг/м3. NH3-возд. смесь поступает на кат.. Применяют комбинированный кат (Pt,Fe,Cr). Выход ок. азота = 96%, 4% NH3 окисляется доN2 . 2-ая стадия окисл. ок.N . Для этого охлаждают нитрозные газы (увел. выход).Нитрозные газы охлаждаются с использованием теплоты экзотермических реакций. Для этого внизу аппарата устанавливается котёл-утилизатор, где вырабатывается водяной пар. Нитрозные газы охлаждаются до 250°С -300°С. Dап. = 4 м, Н = 5.6 м. Охлаждается нитрозный газ в 2-3 ступени: (10) и (11). В (10) нитрозный газ охлаждается до 150°С -120°С, в (11) – до 50-60°С. При этих Т почти полное окисление NO до NO2 и конденсируется водяной пар.
4NH3 + 5O2 = 4NO + 6H2O
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
Нитрозные газы сжимаются до Р=1.1 МПа. Перед подачей нитрозного газа на сжатие из них надо выделить HNO3, следовательно для этого устанавливается промывная колонна. Это тарельчатая колонна. Нитр. г. под нижнюю тарелку, на верхней – сконд. HNO3, который выходит из нижней тарелки и возвращается на орошение, проходя через холодильник. По мере циркуляции объем NHO3 увеличивается, часть ее отбирается и подается на абсорбцию C (HNO3) = 45-50%. В промывной колонне HNO3 отделяется от нитрозного газа. Далее нитр. газ идет в компрессор, сж. до Р=1.1 МПа. За счет их сжатия Т увеличивается следовательно потом устанавливается дополнительный холодильник, где Т уменьшается до 50-60°С. Дальше происходит дополнительное окисление NO до NO2. Нитрозный газ под нижнюю тарелку абс-ой кол.. На верхнюю тарелку – вода, которая стекает вниз, встречается с оксидом азота следовательно на тарелках образуется HNO3 и выделяется втор. NO, который в межтарельчатом пространстве окисляется до NO2. Объём абсорбционной колонны рассчитывают по времени окисления NO до NO2. D=4м, Н=57.7 м,45 ситчатых тарелок. Т. к.реакция экзотермическая, то Т увеличивается в колонне следовательно для поддержания необходимого Т-го режима(40-50°С) на нижних тарелках устанавливается змеевик. вод-ые холод. (на 10 нижних тарелках, т. к. там в основном идёт экзотермическая реакция). С(HNO3) на нижней тарелке 60-65%, на 5-й-51%, на 10-ой-31%, на15-ой-15%, на 20-ой- (7-7.5)%, на 25 -4%, на 30-1.5, на 35- (0.5-0.6)%, на 40-0.05%, на последней – вода.
HNO3 60% растворяет ок. N далее HNO3 из нижней тарелки бурая следовательно. После абсорбционной колонны HNO3 подаётся в отбелочную колонну HNO3 на верхнюю тарелку, под нижнюю – воздух. Идёт десорбция растворённых оксидов азота,дальше кислота обесцвечивается, а затем идёт потребителю.
Степень превращения в HNO3 99.3-99.5%. Концентрация ок. = 0.05% - это выше нормы следовательно обезвреживают каталитическим окислением природного газа при Т=500-600°С. Следовательно перед подачей нитрозного газа на обезвреживание их подогревают до 400-500°С, смешивается с природным газом и в ап..
Нитрозный газ из абсорбционной колонны в брызгоуловитель, т/о, где нагревается до Т=400°С, смешивается с природным газом. В нитр. газе всегда есть О2 (3-4%):
CH4 + O2 =CO + 2H2
Кол-во прир. газа рассчитывается по этой реакции, чтобы образ. восстан-ая атм..
2NO +H2 = N2 +2H2O
Полезно использовать ам. хвост. нитр. г.. Их расширяют в газовой турбине до атмосферного давления после аппарата для кат-го восстановления. Турбина устанавливается на 1 валу с компрессорами для сжатия воздуха и нитрозного газа. Нет расхода энергии на сжатие. Т.е. энерготехнологическая установка. В газовой турбине Т уменьшается до 400-500°С и выбрасывается в атмосферу.
Эта схема позволила уменьшить Т окисления, значит уменьшатся потери Pt-го кат.. Увелич. Р на абс. позволило увеличить степень превращения HNO3 и увеличивается её концентрация.
В схеме кат-ое окисление оксида оксида азота след. нет загрязнения окружающей среды.
Энерготехнолог. Схема: Мощность выше в 3 раза след. меньше капитальные вложения, выше производительность труда.
Окисление NH3. Увеличивать Р больше не можем. Если увеличивать Р до 2-2.5 МПа, то производительность выше в 2 раза, но толщина стенок аппарата увеличится.НЕ РЕАЛИЗОВЫВАЮТ!!!
С (HNO3) = 60-65%. В этой схеме летом 60%, а зимой 65%. Такая концентрация подходит для получения минеральных удобрений.
