
- •Спирты. Фенолы.
- •Номенклатура спиртов
- •Способы получения спиртов
- •Восстановление карбонильных соединений.
- •5. Восстановление кислот и сложных эфиров.
- •Способы получения фенолов
- •3. Гидролиз водных растворов ароматических диазосоединений.
- •Физические свойства спиртов и фенолов. Особенности их строения.
- •Сравнение кислотно-основных свойств спиртов и фенолов
- •Химические свойства
- •Химические свойства спиртов
- •2. Реакция с металлоорганическими соединениями
- •3. Реакция этерификации – образование сложных эфиров
- •4. Реакция с галогеноводородами
- •5.Реакции с галогенидами фосфора и серы
- •6. Кислотная дегидратация спиртов
- •6.1. Образование простых эфиров
- •6.2.Образование алкенов
- •7. Окисление спиртов
- •Химические свойства фенолов
- •2.1. Образование простых алкилариловых эфиров
- •2.2.Образование простых диариловых эфиров
Химические свойства фенолов
Химические свойства фенолов во многом отличны от спиртов, что обусловлено сопряжением гидроксильной группы, проявляющей +М-эффект, с ароматическим кольцом.
Как указывалось ранее, именно этим объясняются более кислые свойства фенолов по сравнению со спиртами и способность образовывать соли – феноляты с гидроксидами металлов и спиртовыми растворами алкоголятов.

В то же время нуклеофильные свойства фенольного гидроксила понижены по сравнению со спиртовым. За счет +М-эффекта существенно изменяются характеристики связи СSP2-О, а именно, появляется некоторая двоесвязанность, что приводит к увеличению ее прочности и уменьшению длины по сравнению со связью СSP3-О в спиртах. Поэтому реакции, связанные с разрывом связи
СSP2-О, встречаются у фенолов очень редко.
Благодаря электронодонорному влиянию фенольного гидроксила, значительно увеличивается электронная плотность ароматического кольца по сравнению с бензолом, особенно в орто- и пара-порложениях. Это существенно облегчает протекание реакций электрофильного замещения и окисления.
При сравнении фенола и фенолят-иона легко выявить не только более высокую нуклеофильность (основность) последнего по кислороду, несущему отрицательный заряд , но и по ароматическому кольцу за счет более сильного смещения в него электронной плотности, как это показано ниже:

Поэтому часто при введении фенолов в реакции нуклеофильного замещения их первоначально переводят в фенолят-ионы.
Реакции
1. Кислотные свойства. Взаимодействие с активными металлами и
щелочами
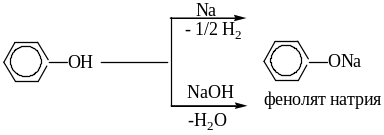
2.Нуклеофильные свойства
2.1. Образование простых алкилариловых эфиров

или

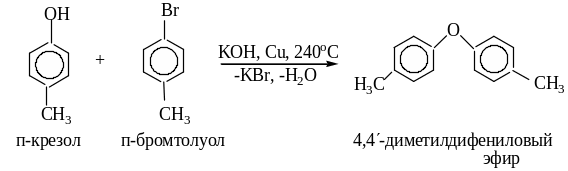
2.2.Образование простых диариловых эфиров
Арилирование фенолов проходит в жестких условиях в присутствии катализатора из-за малой подвижности атома галогена в ароматическом ядре.
2.3. Образование сложных эфиров - реакция ацилирования
Фенолы обладают низкой нуклеофильностью и реагируют только с активными ацилирующими реагентами: ангидридами и хлорангидридами кислот в присутствии кислого или основного катализатора.

Ацильные производные фенолов легко изомеризуются в кислой среде в присутствии избытка AlCl3 (перегруппировка Фриса).


Реакции электрофильного замещения в ароматическом кольце
3.1. Галогенирование

Реакция применяется для обнаружения фенола в воде (помутнение заметно при содержании фенола в воде 1:100000).


3.2. Нитрование

3.3. Сульфирование
Фенол легко сульфируется и в зависимости от температуры преимущественно получают орто- или пара- изомер.

3.4. Алкилирование


3.5. Ацилирование
Ацилирование фенолов хлорангидридами и ангидридами карбоновых кислот по Фриделю-Крафтсу в присутствии AlCl3 обычно не проводят из-за комплексообразования AlCl3 по гидроксигруппе. Образуются нерастворимые феноляты алюминия ArO-AlCl2 и каталитическая активность катализатора пропадает.
Поэтому проводят непрямое ацилирование ( см. 2.3. ), а затем применяют перегруппировку Фриса.

Тем не менее иногда проводят С-ацилирование фенола и его производных в присутствии других катализаторов.

Получение фенолфталеина
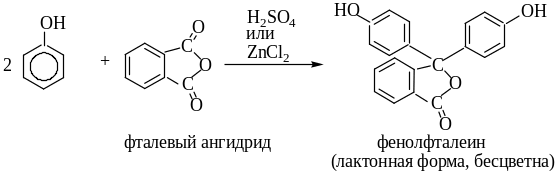

Фенолфталеин используют в качестве индикатора.
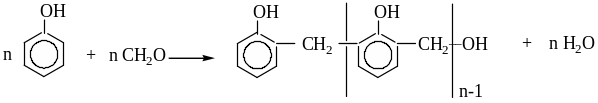
3.6. Реакция с формальдегидом

При щелочном катализе повышается нуклеофильность субстрата (фенол превращается в фенолят-ион), при кислотном - становится более активным электрофильный реагент.
![]()
Взаимодействие фенолов с формальдегидом лежит в основе получения фенолформальдегидных смол – линейных растворимых новолаков (1:1) и сетчатых нерастворимых бакелитов при избытке формальдегида.
 3.7.
Карбоксилирование. Реакция Кольбе-Шмитта
3.7.
Карбоксилирование. Реакция Кольбе-Шмитта

Нуклеофильность кислорода гидроксильной группы и атомов углерода (орто- и пара-положений ) ароматического ядра создает в определенных условиях конкуренцию в реакциях с электрофильными реагентами, то есть реакция может проходить и так:

3.8. Реакция Раймера-Тимана

3.9. Нитрозирование

3.10. О- и С- Нуклеофильность фенолов различна и можно подобрать условия для направленного вступления реагента, например:

4. Реакции замещения фенольного гидроксила затруднены из-за прочности связи Саром --О, но некоторые все-таки удается провести.


5. Восстановление

При перегонке над цинковой пылью фенол дегидроксилируется.

6. Окисление


РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб: «Иван Федоров», 2002. -624с
2. Травень В.Ф. Органическая химия в 2х т.-М: ИКЦ «Академкнига », –Т2, 2005. - 582с
3. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. Органическая химия кн.1.- М: Дрофа, 2004.-640с
4. Нейланд О.Я. Органическая химия.- М: «Высшая школа», 1990.-751с
5. Моррисон Р., Бойд Р. Органическая химия.- М: «Мир», 1974.–1132 с
6. Органическая химия. Методические указания. Часть 4. Составители Завлин П.М., Федосеева А.С.- Л: ЛИКИ, 1984- 54с
7. Янковский С.А., Данилова Н.С. Задачи по органической химии. – М: Колос, 2000.- 328с
8. Вопросы и задачи по органической химии. Под ред. проф. Н.Н. Суворова.- М: «Высшая школа», 1988.-255 с
СОДЕРЖАНИЕ
Спирты. Фенолы. Вопросы теории …………………………………………….3
Литература……………………………………………………………………....37
